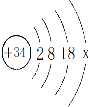
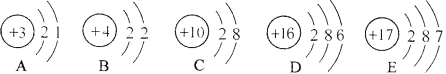题目内容
【题目】(6分)化学是一门以实验为基础的学科,初中化学中进行过很多实验。下面是初中化学中我们曾做过的四个实验,请回答下列有关问题:




A.水的电解 B.铁丝在氧气中燃烧 C. 实验室制取二氧化碳 D.工业炼铁实验
(1)A是实验室电解水的实验。b处产生的气体是 ,常用 检验该气体;
(2)B实验是铁丝在氧气中燃烧的实验.为什么在集气瓶底部留有少量水,这样做的目的是 ;
(3)写出在C实验中制取二氧化碳的化学方程式 ;
(4)D是模拟工业炼铁的实验装置,该实验中发生的化学反应是 ,
在D实验中有不完善的地方,请指出 。
【答案】(1)O2 (1分) 带火星的木条(1分)(2)防止溅落的高温熔融物炸裂集气瓶底(1分)
(3)CaCO3+HCl=CaCl2+H2O+CO2↑(1分)(4)3CO+Fe2O3高温 2Fe+3CO2(1分) 缺少尾气处理装置(1分)
【解析】
试题分析:(1)水电解时,正极产生氧气,能使带火星的木条复燃;(2)铁丝在氧气中燃烧时,为防止溅落的高温熔融物炸裂集气瓶底,应预先在集气瓶底部留有少量水;(3)实验中制取二氧化碳的化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑;(4)炼铁时,是一氧化碳与氧化铁反应生成铁和二氧化碳,化学方程式为:3CO+Fe2O3 高温2Fe+3CO2;一氧化碳有毒,排放到空气中会污染空气,因此在D实验中有不完善的地方,即缺少尾气处理装置。

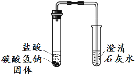
【题目】(7分)化学课上,同学们做了如下两个实验。
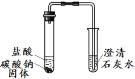
实验装置 | 实验现象 | 实验结论 |
实验Ⅰ 实验Ⅱ | 实验I、II中均观察到:白色固体逐渐减少, ;澄清石灰水变浑浊。 | Na2CO3和NaHCO3都能与盐酸反应产生CO2;NaHCO3与盐酸反应的化学方程式是 。 |
在实验过程中用手触摸试管,发现盛Na2CO3的试管变热,盛NaHCO3的试管变冷。
【提出问题】两个实验过程中,温度变化的原因是什么?
【猜想与假设】甲同学认为:Na2CO3和盐酸反应为放热反应,而NaHCO3和盐酸反应为吸热反应。
乙同学认为甲的猜想有不足之处。
【设计实验】乙同学欲通过实验进行研究,实验步骤如下:
①分别向盛有0.5 g Na2CO3固体、0.5 g NaHCO3固体的烧杯中加入10 mL水(20℃),搅拌,测量温度t1
②静置,测量温度t2
③分别加入10 mL 密度约为1.1 g/mL 20%的盐酸(20℃),搅拌,测量温度t3
【实验记录】多次实验后取平均值记录如下:
t1/℃ | t2/℃ | t3/℃ | |
Na2CO3 | 23.3 | 20.0 | 23.7 |
NaHCO3 | 18.5 | 20.0 | 20.8 |
【分析与结论】
(1)甲同学猜想的不足之处是 。通过步骤①得到的结论是 。
(2)通过步骤②和③得到的结论是:Na2CO3和NaHCO3与盐酸反应都是放热反应。
【反思与评价】
老师指出乙的设计仍存在不足,并补充做如下实验:向盛有10 mL水(20℃)的烧杯中加入10 mL密度约为1.1 g/mL 20%的盐酸(20℃),搅拌,测量温度为22.2℃。
(1)此实验的目的是 。
(2)结合此次探究活动,你认为下列说法不正确的是 (填序号)。
A.盐酸的稀释过程是放热过程
B.NaHCO3与盐酸的反应是放热反应
C.实验Ⅰ和Ⅱ中的能量变化与化学反应、物质的溶解和稀释有关