题目内容
【题目】(12分)碱式碳酸盐广泛应用于工农业生产。
(1)某碱式碳酸盐样品M(OH)2·MCO3,为确定金属M的相对原子质量,某研究小组设计如下实验装置及步骤(不考虑植物油中溶解CO2产生的影响)。
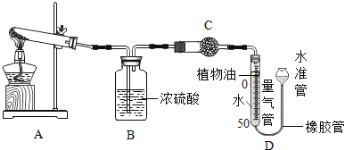
①连接装置并 ;②准确称量样品的质量;③装药品,调节量气装置两边液面相平,读数;④加热至样品质量不再减少;⑤冷却到室温;⑥调节量气装置两边液面相平,读数、列式计算。
Ⅰ.请将上述实验步骤补充完整;
Ⅱ.装置B的作用是 ,少量植物油的作用是 ,C中的试剂是 (填字母序号);
a.碱石灰 b.浓硫酸 c.硫酸铜
Ⅲ.步骤⑥中调节液面相平的操作是将水准管 (填“缓慢上移”或“缓慢下移”)。
Ⅳ.若其他操作均正确,仅因下列因素可使M相对原子质量的测定结果偏大的是 (填字母序号);
a.反应前量气管水面在0刻度处,反应后仰视读数
b.样品未分解完全即停止实验
c.量气管中未加植物油
(2)实际生产中的碱式碳酸铜可表示为Cu(OH)2·mCuCO3,某研究小组仍使用上述装置测定m的值,测得3组数据如下表所示。取3组数据的值得到CO2的体积为 mL,又知常温常压下CO2的密度为1.964 g/L,据此计算m的值。(写出计算m的过程,最后结果保留小数点后两位) 。
组别 | 样品质量 | CO2体积 |
第1组 | 0.21 g | 22.39 mL |
第2组 | 0.21 g | 22.41 mL |
第3组 | 0.21 g | 22.40 mL |
【答案】(1)Ⅰ、检查装置的气密性;Ⅱ、除去水;隔离二氧化碳和水,防止二氧化碳溶于水;C;Ⅲ、缓慢下移;Ⅳ、bc;(2)22.40;1.14.
【解析】
试题分析:(1)Ⅰ、该装置需要准确测定生成二氧化碳的体积,因此使用时必须密封进行,所以实验前一定要先检查装置的气密性;
Ⅱ、由于碱式碳酸盐在加热的条件下分解产物有水和二氧化碳,而装置的最终目的是测定二氧化碳的体积,因此需利用浓硫酸的吸水性除去二氧化碳中的水;少量植物油可以隔离二氧化碳和水,防止二氧化碳溶于水;由于无水硫酸铜粉末遇到水之后可变成蓝色晶体,因此硫酸铜可以验证二氧化碳气体是否干燥完全;
Ⅲ、液面越低压强越小,所以加热A时,随着碳酸盐样品分解,量气管内的液面逐渐下降,为防止量气管内气体压强过大,可将水准管缓慢下移;
Ⅳ、本实验主要通过测量二氧化碳的体积,通过密度已知可以计算二氧化碳的质量,根据化学方程式进而计算M的相对原子质量,由题意可得,样品质量为X,二氧化碳的质量为Y=ρ(CO2)V(CO2),设M的相对原子质量为Ar,得
M(OH)2·MCO3![]() 2MO + H2O + CO2↑
2MO + H2O + CO2↑
2Ar+94 44
X Y
![]()
![]()
反应前量气管水面到0刻度处,反应后仰视读数,读数偏大,二氧化碳体积偏大,Y偏大,M的相对原子质量为Ar偏小;b、样品未分解完全即停止实验,可导致实际测得气体的体积偏小,Y偏小,M的相对原子质量为Ar偏大;c、量气管中未加植物油,二氧化碳溶于水,可导致实际测得气体的体积偏小,Y偏小,M的相对原子质量为Ar偏大,故选bc;
(2)由题意可知,CO2的体积为(22.39mL+22.41mL+22.40mL)÷3 =22.40mL,则CO2的质量为0.0224L×1.964 g/L=0.044g,得
Cu(OH)2mCuCO3 ![]() (1+m)CuO+H2O+mCO2↑
(1+m)CuO+H2O+mCO2↑
98+124m 44m
0.21g 0.044g
![]() m = 1.14
m = 1.14
答:计算m的值为1.14 。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案