题目内容
【题目】为测定某工业纯碱样品(含少量氯化钠杂质)中碳酸钠的含量,取12.0g样品放入烧杯中加入40.0g水全部溶解,,然后取该溶液平分为A、B二等份进行实验。甲组向A中加入一定量7.3%稀盐酸,恰好完全反应。经测定,所得溶液常温下为不饱和溶液,其质量为73.8g。乙组向B溶液滴加一定浓度稀硫酸至过量,测定其pH值变化也测定出了该样品的纯度。
(1)关于乙组实验有下列图像,其中正确的是_______
A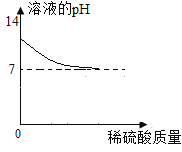 B
B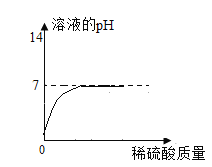 C
C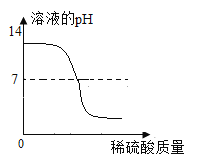 D
D
(2)若要从甲组反应后的溶液中得到氯化钠晶体,还需要进行的操作是____。
(3)样品中碳酸钠的质量为多少?______
【答案】C 蒸发结晶 10.6g
【解析】
(1)碳酸钠溶液显碱性,溶液的pH>7;与盐酸反应生成氯化钠、水和二氧化碳,盐酸过量后显酸性,pH<7,故选C;
(2)氯化钠的溶解度受温度影响不大,故可采用蒸发结晶的方法获取氯化钠晶体。
(3)解: 设样品中碳酸钠的质量为2x,参与甲组反应的碳酸铵的质量为x,参与反应的HCl的质量为y,反应生成的二氧化碳的质量为z,
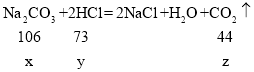
可得,
![]()
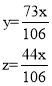
根据质量守恒定律,反应前后质量减少量为生成二氧化碳的质量, ![]()
解得![]()
答:样品中碳酸钠的质量为10.6g。

练习册系列答案
相关题目