题目内容
有一生锈的铁钉(铁锈的主要成份为Fe2O3)质量为16g,加入足量的盐酸充分反应后生成0.4gH2.试计算未生锈前铁片的质量为多少?
考点:根据化学反应方程式的计算
专题:有关化学方程式的计算
分析:根据氢气的质量可以计算铁的质量,根据铁的质量可以计算氧化铁的质量,进一步可以计算未生锈前铁片的质量.
解答:解:设铁的质量为x,
Fe+2HCl═FeCl2+H2↑,
56 2
x 0.4g
=
,
x=11.2g,
氧化铁中铁元素的质量为:(16g-11.2g)×
×100%=3.36g,
未生锈前铁片的质量为:11.2g+3.36g=14.56g,
答:未生锈前铁片的质量为14.56g.
Fe+2HCl═FeCl2+H2↑,
56 2
x 0.4g
| 56 |
| x |
| 2 |
| 0.4g |
x=11.2g,
氧化铁中铁元素的质量为:(16g-11.2g)×
| 112 |
| 160 |
未生锈前铁片的质量为:11.2g+3.36g=14.56g,
答:未生锈前铁片的质量为14.56g.
点评:本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
相关题目
在物质的变化中常伴随一些量的改变,下列有关分析合理的是( )
| A、在蒸馏水润湿的pH试纸来测定稀碳酸钠溶液的pH,结果偏大 |
| B、浓盐酸和浓硫酸露置在空气中,溶质的质量分数都会减小 |
| C、铜片插入稀硫酸溶液中,溶液质量会增加 |
| D、氢氧化钠溶液敞口放置在空气中质量会减少 |
如图是四位同学讨论某一个化学方程式所表达的化学信息,则他们描述的化学方程式能完全符合的是( )


A、2KMnO4
| ||||
B、3CO+Fe2O3
| ||||
| C、Na2CO3+2HCl═2NaCl+H2O+CO2↑ | ||||
| D、2NaOH+H2SO4═Na2SO4+2H2O |

 所示,该元素的原子核外电子层有几个?它属于金属元素还是非金属元素?其在化学反应中易得得到还是失去电子?
所示,该元素的原子核外电子层有几个?它属于金属元素还是非金属元素?其在化学反应中易得得到还是失去电子? 所示的粒子符号,并指出该元素位于哪一周期哪一族.
所示的粒子符号,并指出该元素位于哪一周期哪一族.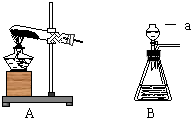 实验室常用高锰酸钾粉末制取氧气(装置A),也可用过氧化氢溶液和催化剂二氧化锰粉末来制取氧气(装置B).装置B中的仪器a是分液漏斗,通过活塞的“开”、“关”可以随时滴加过氧化氢溶液,从而控制得到氧气的质量.
实验室常用高锰酸钾粉末制取氧气(装置A),也可用过氧化氢溶液和催化剂二氧化锰粉末来制取氧气(装置B).装置B中的仪器a是分液漏斗,通过活塞的“开”、“关”可以随时滴加过氧化氢溶液,从而控制得到氧气的质量.