题目内容
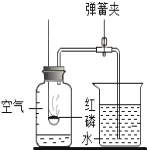
【题目】如图所示的是铁丝在氧气中燃烧的实验,但李阳同学在实验过程中没有见到火星四射的现象.于是李阳准备对此问题产生的原因进行探究.
![]() 李阳认为可能是自己收集的氧气不纯,此时你认为他应该如何改进实验方案________.
李阳认为可能是自己收集的氧气不纯,此时你认为他应该如何改进实验方案________.
![]() 同学小华想帮助李阳搞清铁在氧气中燃烧火星四射的原因,查阅了不少资料,发现用来做燃烧实验的铁丝往往是生铁,生铁中含有少量的碳元素,镁条中不含碳元素,会不会是这个原因造成现象的差异呢?如果你能从炼铁厂收集到纯铁丝、含碳量不同的铁丝(含碳
同学小华想帮助李阳搞清铁在氧气中燃烧火星四射的原因,查阅了不少资料,发现用来做燃烧实验的铁丝往往是生铁,生铁中含有少量的碳元素,镁条中不含碳元素,会不会是这个原因造成现象的差异呢?如果你能从炼铁厂收集到纯铁丝、含碳量不同的铁丝(含碳![]() 、
、![]() 和
和![]() ),在实验室里能找到镁条,请你设计实验,验证是上述原因造成现象差异的.
),在实验室里能找到镁条,请你设计实验,验证是上述原因造成现象差异的.
![]() 设计实验:
设计实验:
实验方法 | 实验现象 |
________ | ________ |
![]() 得出结论:铁丝含碳量越高,火星四射的现象越明显.
得出结论:铁丝含碳量越高,火星四射的现象越明显.
![]() 分析原因:碳元素在燃烧过程中生成了
分析原因:碳元素在燃烧过程中生成了![]() 气体,气体将铁与氧气反应生成的金属熔化物________(用化学式填写)推了出去,从而产生了火星四射现象.
气体,气体将铁与氧气反应生成的金属熔化物________(用化学式填写)推了出去,从而产生了火星四射现象.
【答案】改用纯净的氧气进行实验做纯铁丝或钢丝在纯氧气中燃烧实验;将含碳量不同的铁丝和镁条分别绕在木炭上在纯氧中燃烧镁条没有火星四射现象,含碳量低的铁丝火星四射现象不明显,含碳量高的铁丝能观察到明显火星四射现象Fe3O4
【解析】
(1)李阳认为可能是自己收集的氧气不纯,可改用纯净的氧气进行实验用纯铁丝或钢丝在纯氧气中燃烧;
(3)根据查阅资料可知,火星四射的现象可能与含碳量有关,故实验方法为将含碳量不同的铁丝和镁条分别绕在木炭上在纯氧中燃烧;
实验现象为镁条没有火星四射现象,含碳量低的铁丝火星四射现象不明显,含碳量高的铁丝能观察到明显火星四射现象;
(5)铁与氧气反应生成金属熔化物是四氧化三铁,其化学式为Fe3O4。

 导学教程高中新课标系列答案
导学教程高中新课标系列答案【题目】某品牌可乐由水、白砂糖、焦糖色素(使可乐显黑褐色)、磷酸(H3PO4)等,按一定比例混合并压入二氧化碳配制而成.某同学为了探究可乐的成分及其含量,进行如下实验.
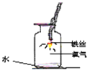
实验一:可乐中二氧化碳的定性检验
(1)请完成下表:
实验步骤 | 实验现象 | 结论 |
打开一塑料瓶装可乐.塞上带导管的橡胶塞,把导管插入________(填化学式)溶液中 | 观察到________ | 可乐中含有二氧化碳 |
实验二:可乐中磷酸的定量测定
测定过程如图:

(2)步驟①用活性炭浸泡的目的是________.
(3)步骤③煮沸10min的目的是除尽滤液中的________.
(4)已知步骤④反应的化学方程式为H3PO4+NaOH=NaH2PO4+H2O,测得共消耗0.1%的NaOH溶液20g,忽略可乐中其它成分对测定结果的影响,计算可乐中磷酸的含量________(以g/L为单位.相对分子质量:H3PO4-98;NaOH-40),写出计算过程.
(5)如果步骤②缺少洗涤,则测定结果________(填“偏高”,“不变”或“偏低”).