题目内容
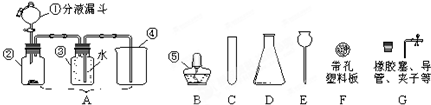
 某小组将一定质量的氧化铜粉末放入如图的装置中进行实验.分析该装置存在的问题后,你认为完善装置的具体方法是________.实验开始时为了排除试管中剩余的空气应________;当看到________时证明氧化铜已完全转化成了铜,此时结束反应,正确的操作顺序是________.冷却后称量剩余固体的质量是6.4g,则有多少摩尔一氧化碳参加了反应.
某小组将一定质量的氧化铜粉末放入如图的装置中进行实验.分析该装置存在的问题后,你认为完善装置的具体方法是________.实验开始时为了排除试管中剩余的空气应________;当看到________时证明氧化铜已完全转化成了铜,此时结束反应,正确的操作顺序是________.冷却后称量剩余固体的质量是6.4g,则有多少摩尔一氧化碳参加了反应.
试管口加橡皮塞、b处点燃 先通一氧化碳后加热 硬质玻璃管(或A)中固体全部变为红色 先停止加热后停止通一氧化碳
分析:根据一氧化碳是对大气有污染的气体,分析完善装置的具体方法;根据一氧化碳是可燃性的气体,与空气的混合气体在点燃时易爆炸分析开始时的操作;根据氧化铜和铜的颜色的不同,分析反应进行的程度;根据还原出的热的铜易于空气中的氧气反应,分析反应结束时的操作.根据一氧化碳还原氧化铜的方程式,由铜的质量求出参加了反应一氧化碳的物质的量.
解答:由于一氧化碳对大气有污染;所以完善装置的具体方法是试管口加橡皮塞,b处点燃;由于一氧化碳是可燃性的气体,与空气的混合气体在点燃时易爆炸.所以,开始时为了排除试管中剩余的空气应先通一氧化碳后加热;当看到硬质玻璃管中固体全部变为红色时,证明氧化铜已完全转化成了铜;由于刚还原出的铜是热的,易于空气中的氧气反应重新生成了氧化铜.所以,反应结束时的操作是:先停止加热后停止通一氧化碳.
设参加反应的一氧化碳的物质的量为x;
生成铜的物质的量为: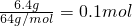
CO+CuO Cu+CO2
Cu+CO2
1 1
X 0.1mol
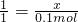 X=0.1mol
X=0.1mol
故答为:试管口加橡皮塞,b处点燃;先通一氧化碳后加热;硬质玻璃管中固体全部变为红色;先停止加热后停止通一氧化碳;有0.1mol的一氧化碳参加了反应.
点评:本题主要考查了一氧化碳还原氧化铜的实验.要完成好本题,就要全面地掌握一氧化碳的可燃性、对大气的污染、一氧化碳还原氧化铜的操作步骤及注意的事项等知识.
分析:根据一氧化碳是对大气有污染的气体,分析完善装置的具体方法;根据一氧化碳是可燃性的气体,与空气的混合气体在点燃时易爆炸分析开始时的操作;根据氧化铜和铜的颜色的不同,分析反应进行的程度;根据还原出的热的铜易于空气中的氧气反应,分析反应结束时的操作.根据一氧化碳还原氧化铜的方程式,由铜的质量求出参加了反应一氧化碳的物质的量.
解答:由于一氧化碳对大气有污染;所以完善装置的具体方法是试管口加橡皮塞,b处点燃;由于一氧化碳是可燃性的气体,与空气的混合气体在点燃时易爆炸.所以,开始时为了排除试管中剩余的空气应先通一氧化碳后加热;当看到硬质玻璃管中固体全部变为红色时,证明氧化铜已完全转化成了铜;由于刚还原出的铜是热的,易于空气中的氧气反应重新生成了氧化铜.所以,反应结束时的操作是:先停止加热后停止通一氧化碳.
设参加反应的一氧化碳的物质的量为x;
生成铜的物质的量为:
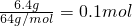
CO+CuO
 Cu+CO2
Cu+CO21 1
X 0.1mol
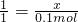 X=0.1mol
X=0.1mol 故答为:试管口加橡皮塞,b处点燃;先通一氧化碳后加热;硬质玻璃管中固体全部变为红色;先停止加热后停止通一氧化碳;有0.1mol的一氧化碳参加了反应.
点评:本题主要考查了一氧化碳还原氧化铜的实验.要完成好本题,就要全面地掌握一氧化碳的可燃性、对大气的污染、一氧化碳还原氧化铜的操作步骤及注意的事项等知识.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
 (1)时下有些年轻人喜欢染发,染发时一般要用到一种着色剂--对苯二胺,其化学式为C6H8N2.它是一种有毒的化学药品,会对染发者的身体带来伤害.
(1)时下有些年轻人喜欢染发,染发时一般要用到一种着色剂--对苯二胺,其化学式为C6H8N2.它是一种有毒的化学药品,会对染发者的身体带来伤害.
①对苯二胺的相对分子质量为______:
②108g对苯二胺中含氢元素的质量为______.
(2)某研究性学习小组对一包NaHCO3和KHCO3的混合物样品进行了如下探究,请按要求完成下列探究报告,提示:
2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑
2KHCO3+H2SO4=K2SO4+2H2O+2CO2↑
探究目的:实验测定样品中NaHCO3和KHCO3物质质量之比,
探究思路:设计实验测量有关反应物和生成物的量,并通过计算确定样品中NaHCO3和KHCO3物质质量之比.
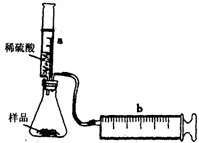
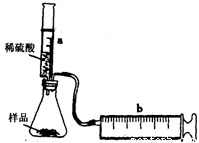
实验探究:实验装置如图所示.将一定质量的混合物样品加入锥形瓶中,用针筒a注入一定体积的稀硫酸充分反应,再用针筒b收集生成气体的体积(忽略针筒管壁间的摩擦).如果往锥形瓶中注入的稀硫酸的体积为V1mL,充分反应后,针筒b中气体的读数为V2mL,则反应中生成的CO2气体体积约为______mL.
结果处理:锥形瓶中放有混合均匀的NaHCO3和KHCO3的样品3.6g,向锥形瓶中滴入一定量的稀硫酸,生成的气体质量(已经过体积换算)与加入的稀硫酸的体积关系如下表所示:
| 硫酸的体积(mL) | 5 | 10 | 15 | 20 | 25 |
| 二氧化碳的质量(g) | 0.44 | 0.88 | a | 1.76 | 1.76 |
②NaHCO3和KHCO3的混合物样品中氧元素的质量分数______.(结果精确到0.1%)
③样品中NaHCO3和KHCO3物质的质量之比为______.
(1)时下有些年轻人喜欢染发,染发时一般要用到一种着色剂--对苯二胺,其化学式为C6H8N2.它是一种有毒的化学药品,会对染发者的身体带来伤害.
①对苯二胺的相对分子质量为______:
②108g对苯二胺中含氢元素的质量为______.
(2)某研究性学习小组对一包NaHCO3和KHCO3的混合物样品进行了如下探究,请按要求完成下列探究报告,提示:
2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑
2KHCO3+H2SO4=K2SO4+2H2O+2CO2↑
探究目的:实验测定样品中NaHCO3和KHCO3物质质量之比,
探究思路:设计实验测量有关反应物和生成物的量,并通过计算确定样品中NaHCO3和KHCO3物质质量之比.
实验探究:实验装置如图所示.将一定质量的混合物样品加入锥形瓶中,用针筒a注入一定体积的稀硫酸充分反应,再用针筒b收集生成气体的体积(忽略针筒管壁间的摩擦).如果往锥形瓶中注入的稀硫酸的体积为V1mL,充分反应后,针筒b中气体的读数为V2mL,则反应中生成的CO2气体体积约为______mL.
结果处理:锥形瓶中放有混合均匀的NaHCO3和KHCO3的样品3.6g,向锥形瓶中滴入一定量的稀硫酸,生成的气体质量(已经过体积换算)与加入的稀硫酸的体积关系如下表所示:
①a=______g
②NaHCO3和KHCO3的混合物样品中氧元素的质量分数______.(结果精确到0.1%)
③样品中NaHCO3和KHCO3物质的质量之比为______.

①对苯二胺的相对分子质量为______:
②108g对苯二胺中含氢元素的质量为______.
(2)某研究性学习小组对一包NaHCO3和KHCO3的混合物样品进行了如下探究,请按要求完成下列探究报告,提示:
2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑
2KHCO3+H2SO4=K2SO4+2H2O+2CO2↑
探究目的:实验测定样品中NaHCO3和KHCO3物质质量之比,
探究思路:设计实验测量有关反应物和生成物的量,并通过计算确定样品中NaHCO3和KHCO3物质质量之比.
实验探究:实验装置如图所示.将一定质量的混合物样品加入锥形瓶中,用针筒a注入一定体积的稀硫酸充分反应,再用针筒b收集生成气体的体积(忽略针筒管壁间的摩擦).如果往锥形瓶中注入的稀硫酸的体积为V1mL,充分反应后,针筒b中气体的读数为V2mL,则反应中生成的CO2气体体积约为______mL.
结果处理:锥形瓶中放有混合均匀的NaHCO3和KHCO3的样品3.6g,向锥形瓶中滴入一定量的稀硫酸,生成的气体质量(已经过体积换算)与加入的稀硫酸的体积关系如下表所示:
| 硫酸的体积(mL) | 5 | 10 | 15 | 20 | 25 |
| 二氧化碳的质量(g) | 0.44 | 0.88 | a | 1.76 | 1.76 |
②NaHCO3和KHCO3的混合物样品中氧元素的质量分数______.(结果精确到0.1%)
③样品中NaHCO3和KHCO3物质的质量之比为______.

(1)时下有些年轻人喜欢染发,染发时一般要用到一种着色剂--对苯二胺,其化学式为C6H8N2.它是一种有毒的化学药品,会对染发者的身体带来伤害.
①对苯二胺的相对分子质量为______:
②108g对苯二胺中含氢元素的质量为______.
(2)某研究性学习小组对一包NaHCO3和KHCO3的混合物样品进行了如下探究,请按要求完成下列探究报告,提示:
2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑
2KHCO3+H2SO4=K2SO4+2H2O+2CO2↑
探究目的:实验测定样品中NaHCO3和KHCO3物质质量之比,
探究思路:设计实验测量有关反应物和生成物的量,并通过计算确定样品中NaHCO3和KHCO3物质质量之比.
实验探究:实验装置如图所示.将一定质量的混合物样品加入锥形瓶中,用针筒a注入一定体积的稀硫酸充分反应,再用针筒b收集生成气体的体积(忽略针筒管壁间的摩擦).如果往锥形瓶中注入的稀硫酸的体积为V1mL,充分反应后,针筒b中气体的读数为V2mL,则反应中生成的CO2气体体积约为______mL.
结果处理:锥形瓶中放有混合均匀的NaHCO3和KHCO3的样品3.6g,向锥形瓶中滴入一定量的稀硫酸,生成的气体质量(已经过体积换算)与加入的稀硫酸的体积关系如下表所示:
①a=______g
②NaHCO3和KHCO3的混合物样品中氧元素的质量分数______.(结果精确到0.1%)
③样品中NaHCO3和KHCO3物质的质量之比为______.
①对苯二胺的相对分子质量为______:
②108g对苯二胺中含氢元素的质量为______.
(2)某研究性学习小组对一包NaHCO3和KHCO3的混合物样品进行了如下探究,请按要求完成下列探究报告,提示:
2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑
2KHCO3+H2SO4=K2SO4+2H2O+2CO2↑
探究目的:实验测定样品中NaHCO3和KHCO3物质质量之比,
探究思路:设计实验测量有关反应物和生成物的量,并通过计算确定样品中NaHCO3和KHCO3物质质量之比.
实验探究:实验装置如图所示.将一定质量的混合物样品加入锥形瓶中,用针筒a注入一定体积的稀硫酸充分反应,再用针筒b收集生成气体的体积(忽略针筒管壁间的摩擦).如果往锥形瓶中注入的稀硫酸的体积为V1mL,充分反应后,针筒b中气体的读数为V2mL,则反应中生成的CO2气体体积约为______mL.
结果处理:锥形瓶中放有混合均匀的NaHCO3和KHCO3的样品3.6g,向锥形瓶中滴入一定量的稀硫酸,生成的气体质量(已经过体积换算)与加入的稀硫酸的体积关系如下表所示:
| 硫酸的体积(mL) | 5 | 10 | 15 | 20 | 25 |
| 二氧化碳的质量(g) | 0.44 | 0.88 | a | 1.76 | 1.76 |
②NaHCO3和KHCO3的混合物样品中氧元素的质量分数______.(结果精确到0.1%)
③样品中NaHCO3和KHCO3物质的质量之比为______.

 (1)时下有些年轻人喜欢染发,染发时一般要用到一种着色剂--对苯二胺,其化学式为C6H8N2.它是一种有毒的化学药品,会对染发者的身体带来伤害.
(1)时下有些年轻人喜欢染发,染发时一般要用到一种着色剂--对苯二胺,其化学式为C6H8N2.它是一种有毒的化学药品,会对染发者的身体带来伤害.