题目内容
 (1)时下有些年轻人喜欢染发,染发时一般要用到一种着色剂--对苯二胺,其化学式为C6H8N2.它是一种有毒的化学药品,会对染发者的身体带来伤害.
(1)时下有些年轻人喜欢染发,染发时一般要用到一种着色剂--对苯二胺,其化学式为C6H8N2.它是一种有毒的化学药品,会对染发者的身体带来伤害.
①对苯二胺的相对分子质量为______:
②108g对苯二胺中含氢元素的质量为______.
(2)某研究性学习小组对一包NaHCO3和KHCO3的混合物样品进行了如下探究,请按要求完成下列探究报告,提示:
2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑
2KHCO3+H2SO4=K2SO4+2H2O+2CO2↑
探究目的:实验测定样品中NaHCO3和KHCO3物质质量之比,
探究思路:设计实验测量有关反应物和生成物的量,并通过计算确定样品中NaHCO3和KHCO3物质质量之比.
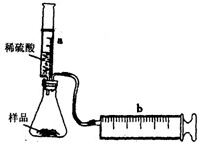
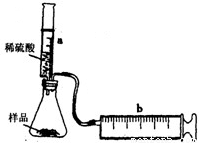
实验探究:实验装置如图所示.将一定质量的混合物样品加入锥形瓶中,用针筒a注入一定体积的稀硫酸充分反应,再用针筒b收集生成气体的体积(忽略针筒管壁间的摩擦).如果往锥形瓶中注入的稀硫酸的体积为V1mL,充分反应后,针筒b中气体的读数为V2mL,则反应中生成的CO2气体体积约为______mL.
结果处理:锥形瓶中放有混合均匀的NaHCO3和KHCO3的样品3.6g,向锥形瓶中滴入一定量的稀硫酸,生成的气体质量(已经过体积换算)与加入的稀硫酸的体积关系如下表所示:
| 硫酸的体积(mL) | 5 | 10 | 15 | 20 | 25 |
| 二氧化碳的质量(g) | 0.44 | 0.88 | a | 1.76 | 1.76 |
②NaHCO3和KHCO3的混合物样品中氧元素的质量分数______.(结果精确到0.1%)
③样品中NaHCO3和KHCO3物质的质量之比为______.
解:(1)①对苯二胺的相对分子质量=12×6+1×8+14×2=108;
②对苯二胺中含氢元素的质量=108g× =8g.
=8g.
故答案为:(1)①108;②8g;
(2)由于在密闭体系中注入V1mL的硫酸,导致此时注射器中也应该为V1mL才能维持内部压强相等,所以后来生成的气体会导致体积在V1mL的基础上增大(硫酸消耗引起的体积变化可以忽略不计),所以二氧化碳的体积为两者的差,即V2-V1mL,故答案为:V2-V1.
从表中数据可以看出,前两次,每加5mL的硫酸都生成0.44g二氧化碳,且到第四次是为1.76g(0.44g×4=1.76g),说明前四次都是酸完全反应,所以第三次的硫酸也是完全反应,所以a为0.44g×3=1.32g.故答案为1.32.
当加入第四次硫酸时完全反应生成的二氧化碳的质量为1.76g
2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑
2KHCO3+H2SO4=K2SO4+2H2O+2CO2↑
通过方程式可以看出,混合物中的氧原子与生成的二氧化碳中的氧原子的个数比为6:4,而混合物中的氧原子与二氧化碳分子的个数比为6:2
所以有6O~~2CO2,设原混合物中氧元素的质量为x
6O~~2CO2
96 88
x 1.76g
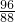 =
=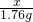
x=1.92g.
NaHCO3和KHCO3的混合物样品中氧元素的质量分数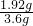 ×100%≈53.3%.故答案为:53.3%
×100%≈53.3%.故答案为:53.3%
设混合物中碳酸氢钠的质量为y,则碳酸氢钾的质量为3.6g-y,设碳酸氢钠对应的二氧化碳的质量为z.
2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑
168 88
y z
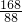 =
=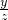
2KHCO3+H2SO4=K2SO4+2H2O+2CO2↑
200 88
3.6g-y 1.76g-z
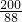 =
=
y=2.1g即碳酸氢钠的质量为2.1g,碳酸氢钾的质量为1.5g.两者质量为2.1:1.5=7:5
分析:(1)①化合物的相对分子质量就等于各原子的相对原子质量的总和;②化合物中某元素的质量=该物质的质量×某元素的质量的质量分数.
(2)题目给出了相对复杂的解题信息,给出了一些复杂的数据,但是如果认真提炼会发现第一问其实生成的二氧化碳的体积,由于在密闭体系中注入V1mL的硫酸,导致此时注射器中也应该为V1mL才能维持内部压强相等,所以后来生成的气体会导致体积在V1mL的基础上增大(硫酸消耗引起的体积变化可以忽略不计),所以二氧化碳的体积为两者的差.
后面的计算要根据给出的数据进行分析,之后借助解题的一些技巧来计算即可.
点评:本题主要考查了学生对化学式的正确理解,以及关于化学式的一些计算,难度不大,要加强理解记忆.
②对苯二胺中含氢元素的质量=108g×
 =8g.
=8g.故答案为:(1)①108;②8g;
(2)由于在密闭体系中注入V1mL的硫酸,导致此时注射器中也应该为V1mL才能维持内部压强相等,所以后来生成的气体会导致体积在V1mL的基础上增大(硫酸消耗引起的体积变化可以忽略不计),所以二氧化碳的体积为两者的差,即V2-V1mL,故答案为:V2-V1.
从表中数据可以看出,前两次,每加5mL的硫酸都生成0.44g二氧化碳,且到第四次是为1.76g(0.44g×4=1.76g),说明前四次都是酸完全反应,所以第三次的硫酸也是完全反应,所以a为0.44g×3=1.32g.故答案为1.32.
当加入第四次硫酸时完全反应生成的二氧化碳的质量为1.76g
2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑
2KHCO3+H2SO4=K2SO4+2H2O+2CO2↑
通过方程式可以看出,混合物中的氧原子与生成的二氧化碳中的氧原子的个数比为6:4,而混合物中的氧原子与二氧化碳分子的个数比为6:2
所以有6O~~2CO2,设原混合物中氧元素的质量为x
6O~~2CO2
96 88
x 1.76g
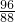 =
=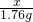
x=1.92g.
NaHCO3和KHCO3的混合物样品中氧元素的质量分数
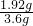 ×100%≈53.3%.故答案为:53.3%
×100%≈53.3%.故答案为:53.3%设混合物中碳酸氢钠的质量为y,则碳酸氢钾的质量为3.6g-y,设碳酸氢钠对应的二氧化碳的质量为z.
2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑
168 88
y z
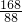 =
=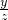
2KHCO3+H2SO4=K2SO4+2H2O+2CO2↑
200 88
3.6g-y 1.76g-z
 =
=
y=2.1g即碳酸氢钠的质量为2.1g,碳酸氢钾的质量为1.5g.两者质量为2.1:1.5=7:5
分析:(1)①化合物的相对分子质量就等于各原子的相对原子质量的总和;②化合物中某元素的质量=该物质的质量×某元素的质量的质量分数.
(2)题目给出了相对复杂的解题信息,给出了一些复杂的数据,但是如果认真提炼会发现第一问其实生成的二氧化碳的体积,由于在密闭体系中注入V1mL的硫酸,导致此时注射器中也应该为V1mL才能维持内部压强相等,所以后来生成的气体会导致体积在V1mL的基础上增大(硫酸消耗引起的体积变化可以忽略不计),所以二氧化碳的体积为两者的差.
后面的计算要根据给出的数据进行分析,之后借助解题的一些技巧来计算即可.
点评:本题主要考查了学生对化学式的正确理解,以及关于化学式的一些计算,难度不大,要加强理解记忆.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
(1)时下有些年轻人喜欢染发,染发时一般要用到一种着色剂--对苯二胺,其化学式为C6H8N2.它是一种有毒的化学药品,会对染发者的身体带来伤害.
①对苯二胺的相对分子质量为______:
②108g对苯二胺中含氢元素的质量为______.
(2)某研究性学习小组对一包NaHCO3和KHCO3的混合物样品进行了如下探究,请按要求完成下列探究报告,提示:
2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑
2KHCO3+H2SO4=K2SO4+2H2O+2CO2↑
探究目的:实验测定样品中NaHCO3和KHCO3物质质量之比,
探究思路:设计实验测量有关反应物和生成物的量,并通过计算确定样品中NaHCO3和KHCO3物质质量之比.
实验探究:实验装置如图所示.将一定质量的混合物样品加入锥形瓶中,用针筒a注入一定体积的稀硫酸充分反应,再用针筒b收集生成气体的体积(忽略针筒管壁间的摩擦).如果往锥形瓶中注入的稀硫酸的体积为V1mL,充分反应后,针筒b中气体的读数为V2mL,则反应中生成的CO2气体体积约为______mL.
结果处理:锥形瓶中放有混合均匀的NaHCO3和KHCO3的样品3.6g,向锥形瓶中滴入一定量的稀硫酸,生成的气体质量(已经过体积换算)与加入的稀硫酸的体积关系如下表所示:
①a=______g
②NaHCO3和KHCO3的混合物样品中氧元素的质量分数______.(结果精确到0.1%)
③样品中NaHCO3和KHCO3物质的质量之比为______.
①对苯二胺的相对分子质量为______:
②108g对苯二胺中含氢元素的质量为______.
(2)某研究性学习小组对一包NaHCO3和KHCO3的混合物样品进行了如下探究,请按要求完成下列探究报告,提示:
2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑
2KHCO3+H2SO4=K2SO4+2H2O+2CO2↑
探究目的:实验测定样品中NaHCO3和KHCO3物质质量之比,
探究思路:设计实验测量有关反应物和生成物的量,并通过计算确定样品中NaHCO3和KHCO3物质质量之比.
实验探究:实验装置如图所示.将一定质量的混合物样品加入锥形瓶中,用针筒a注入一定体积的稀硫酸充分反应,再用针筒b收集生成气体的体积(忽略针筒管壁间的摩擦).如果往锥形瓶中注入的稀硫酸的体积为V1mL,充分反应后,针筒b中气体的读数为V2mL,则反应中生成的CO2气体体积约为______mL.
结果处理:锥形瓶中放有混合均匀的NaHCO3和KHCO3的样品3.6g,向锥形瓶中滴入一定量的稀硫酸,生成的气体质量(已经过体积换算)与加入的稀硫酸的体积关系如下表所示:
| 硫酸的体积(mL) | 5 | 10 | 15 | 20 | 25 |
| 二氧化碳的质量(g) | 0.44 | 0.88 | a | 1.76 | 1.76 |
②NaHCO3和KHCO3的混合物样品中氧元素的质量分数______.(结果精确到0.1%)
③样品中NaHCO3和KHCO3物质的质量之比为______.

(1)时下有些年轻人喜欢染发,染发时一般要用到一种着色剂--对苯二胺,其化学式为C6H8N2.它是一种有毒的化学药品,会对染发者的身体带来伤害.
①对苯二胺的相对分子质量为______:
②108g对苯二胺中含氢元素的质量为______.
(2)某研究性学习小组对一包NaHCO3和KHCO3的混合物样品进行了如下探究,请按要求完成下列探究报告,提示:
2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑
2KHCO3+H2SO4=K2SO4+2H2O+2CO2↑
探究目的:实验测定样品中NaHCO3和KHCO3物质质量之比,
探究思路:设计实验测量有关反应物和生成物的量,并通过计算确定样品中NaHCO3和KHCO3物质质量之比.
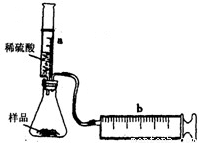
实验探究:实验装置如图所示.将一定质量的混合物样品加入锥形瓶中,用针筒a注入一定体积的稀硫酸充分反应,再用针筒b收集生成气体的体积(忽略针筒管壁间的摩擦).如果往锥形瓶中注入的稀硫酸的体积为V1mL,充分反应后,针筒b中气体的读数为V2mL,则反应中生成的CO2气体体积约为______mL.
结果处理:锥形瓶中放有混合均匀的NaHCO3和KHCO3的样品3.6g,向锥形瓶中滴入一定量的稀硫酸,生成的气体质量(已经过体积换算)与加入的稀硫酸的体积关系如下表所示:
①a=______g
②NaHCO3和KHCO3的混合物样品中氧元素的质量分数______.(结果精确到0.1%)
③样品中NaHCO3和KHCO3物质的质量之比为______.
①对苯二胺的相对分子质量为______:
②108g对苯二胺中含氢元素的质量为______.
(2)某研究性学习小组对一包NaHCO3和KHCO3的混合物样品进行了如下探究,请按要求完成下列探究报告,提示:
2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑
2KHCO3+H2SO4=K2SO4+2H2O+2CO2↑
探究目的:实验测定样品中NaHCO3和KHCO3物质质量之比,
探究思路:设计实验测量有关反应物和生成物的量,并通过计算确定样品中NaHCO3和KHCO3物质质量之比.
实验探究:实验装置如图所示.将一定质量的混合物样品加入锥形瓶中,用针筒a注入一定体积的稀硫酸充分反应,再用针筒b收集生成气体的体积(忽略针筒管壁间的摩擦).如果往锥形瓶中注入的稀硫酸的体积为V1mL,充分反应后,针筒b中气体的读数为V2mL,则反应中生成的CO2气体体积约为______mL.
结果处理:锥形瓶中放有混合均匀的NaHCO3和KHCO3的样品3.6g,向锥形瓶中滴入一定量的稀硫酸,生成的气体质量(已经过体积换算)与加入的稀硫酸的体积关系如下表所示:
| 硫酸的体积(mL) | 5 | 10 | 15 | 20 | 25 |
| 二氧化碳的质量(g) | 0.44 | 0.88 | a | 1.76 | 1.76 |
②NaHCO3和KHCO3的混合物样品中氧元素的质量分数______.(结果精确到0.1%)
③样品中NaHCO3和KHCO3物质的质量之比为______.

 (1)时下有些年轻人喜欢染发,染发时一般要用到一种着色剂--对苯二胺,其化学式为C6H8N2.它是一种有毒的化学药品,会对染发者的身体带来伤害.
(1)时下有些年轻人喜欢染发,染发时一般要用到一种着色剂--对苯二胺,其化学式为C6H8N2.它是一种有毒的化学药品,会对染发者的身体带来伤害.