题目内容
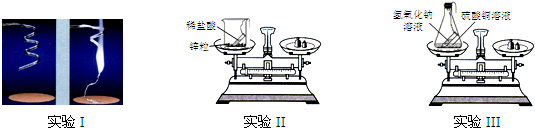
某课外兴趣小组的同学为了探究金属X、Y、Z三种金属的活动性顺序,设计并完成了下图所示的二组实验:
实验一:把金属X、Y、Z三种金属分别放入溶液中
| 实验 | 实验步骤 | 实验现象 |
| ① | 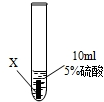 | X片表面无明显变化 |
| ② | 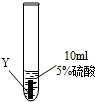 | Y片表面无明显变化 |
| ③ | 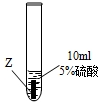 | Z片溶解,表面有无色氢气产生,溶液最终为无色 |
(1)Z与硫酸反应后,生成+3价金属离子,写出实验③的化学方程式:______.
(2)通过上述实验,你认为上述三种金属最活泼是:______.
实验二:把X、Y两种金属丝放入硝酸银溶液中
| 实验 | 实验步骤 | 实验现象 |
| ④ | 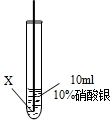 | 在X丝表面有银白色的固体析出 |
| ⑤ | 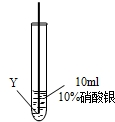 | 在Y丝表面没有明显现象 |
实验三:小组同学选择“Z丝和硫酸反应的快慢与什么因素有关”的课题开展探究.下表是他们分别用相同质量的Z丝和足量稀硫酸反应的三组实验数据:
| 实验编号 | 硫酸的质量分数/% | 反应的温度 | Z丝消失的时间/S |
| ⑥ | 3 | 20 | 500 |
| ⑦ | 6 | 20 | 300 |
| ⑧ | 6 | 30 | 80 |
(5)能表明硫酸浓度对反应快慢有影响的实验编号是:______和______
(6)如果实验⑥中硫酸的质量分数改为4%,请推出Z丝消失的时间(用t表示)的取值范围_______
(7)该实验除了用Z丝消失的时间来衡量反应的快慢外,你还能提出新的方法来衡量反应的快慢吗?方法______.
解:(1)Z与硫酸反应后,生成+3价金属离子,根据化合价写出化学式,再写出方程式:2Z+3H2SO4=Z2(SO4)3+3H2↑;
(2)根据金属活动性顺表,结合实验的现象:X、Y不不与硫酸反应,Z与硫酸反应,最活泼的是Z;
(3)根据实验的现象,X比银活泼,银比Y活泼,最活泼的是Z,综合以上实验,三种金属的活泼性强弱是:Z>X>Y;
(4)对比分析实验⑦和⑧,硫酸的质量分数相同,温度不同,反应的时间不同,表明:该反应快慢与温度有关;
(5)实验⑥和⑦硫酸质量分数不同,温度相同,反应时间不同,表明硫酸浓度对反应快慢有影响;
(6)因为硫酸质量分数越大反应越快,如果实验⑥中硫酸的质量分数改为4%,4%在3%和6%之间,反应的时间应在300S 和500S 之间,所以,300S<t<500S;
(7)实验除了用Z丝消失的时间来衡量反应的快慢外,衡量反应快慢的方法比较多,例如:用排水法收集等体积的一瓶氢气所需时间的多少来衡量,或通过单位时间内产生氢气的量来衡量等.
故答为:(1)2Z+3H2SO4=Z2(SO4)3+3H2↑;
(2)Z;
(3)Z>X>Y;
(4)温度;
(5)⑥和⑦;
(6)300S<t<500S;
(7)用排水法收集等体积的一瓶氢气所需时间的多少来衡量.
分析:(1)金属Z与硫酸反应生成硫酸Z和氢气,根据化合价写出化学式再写出方程式;
(2)根据金属活动性顺表,结合实验的现象,分析活动性最强的金属;
(3)根据上述实验,结合X、Y两种金属与硝酸银溶液反应的现象,分析X、Y、Z三种金属活动性的强弱顺序;
(4)对比分析实验⑦和⑧,硫酸的质量分数相同,温度不同,反应的时间不同,表明:该反应快慢与温度有关;
(5)要找出硫酸浓度对反应快慢有影响的实验,就要分析,硫酸浓度不同,温度相同,反应时间不同的实验;
(6)硫酸浓度越大反应越快,如果实验⑥中硫酸的质量分数改为4%,4%在3%和6%之间,反应的时间应在300S 和500S 之间,所以,300S<t<500S;
(7)实验除了用Z丝消失的时间来衡量反应的快慢外,衡量反应快慢的方法比较多,例如:用排水法收集等体积的一瓶氢气所需时间的多少来衡量,或通过单位时间内产生氢气的量来衡量等.
点评:本题比较全面的考查了金属活动性顺序的应用,通过实验探究了影响反应快慢的因素,掌握实验探究的思路和方法.
(2)根据金属活动性顺表,结合实验的现象:X、Y不不与硫酸反应,Z与硫酸反应,最活泼的是Z;
(3)根据实验的现象,X比银活泼,银比Y活泼,最活泼的是Z,综合以上实验,三种金属的活泼性强弱是:Z>X>Y;
(4)对比分析实验⑦和⑧,硫酸的质量分数相同,温度不同,反应的时间不同,表明:该反应快慢与温度有关;
(5)实验⑥和⑦硫酸质量分数不同,温度相同,反应时间不同,表明硫酸浓度对反应快慢有影响;
(6)因为硫酸质量分数越大反应越快,如果实验⑥中硫酸的质量分数改为4%,4%在3%和6%之间,反应的时间应在300S 和500S 之间,所以,300S<t<500S;
(7)实验除了用Z丝消失的时间来衡量反应的快慢外,衡量反应快慢的方法比较多,例如:用排水法收集等体积的一瓶氢气所需时间的多少来衡量,或通过单位时间内产生氢气的量来衡量等.
故答为:(1)2Z+3H2SO4=Z2(SO4)3+3H2↑;
(2)Z;
(3)Z>X>Y;
(4)温度;
(5)⑥和⑦;
(6)300S<t<500S;
(7)用排水法收集等体积的一瓶氢气所需时间的多少来衡量.
分析:(1)金属Z与硫酸反应生成硫酸Z和氢气,根据化合价写出化学式再写出方程式;
(2)根据金属活动性顺表,结合实验的现象,分析活动性最强的金属;
(3)根据上述实验,结合X、Y两种金属与硝酸银溶液反应的现象,分析X、Y、Z三种金属活动性的强弱顺序;
(4)对比分析实验⑦和⑧,硫酸的质量分数相同,温度不同,反应的时间不同,表明:该反应快慢与温度有关;
(5)要找出硫酸浓度对反应快慢有影响的实验,就要分析,硫酸浓度不同,温度相同,反应时间不同的实验;
(6)硫酸浓度越大反应越快,如果实验⑥中硫酸的质量分数改为4%,4%在3%和6%之间,反应的时间应在300S 和500S 之间,所以,300S<t<500S;
(7)实验除了用Z丝消失的时间来衡量反应的快慢外,衡量反应快慢的方法比较多,例如:用排水法收集等体积的一瓶氢气所需时间的多少来衡量,或通过单位时间内产生氢气的量来衡量等.
点评:本题比较全面的考查了金属活动性顺序的应用,通过实验探究了影响反应快慢的因素,掌握实验探究的思路和方法.

练习册系列答案
相关题目


 某课外兴趣小组的同学所做的下列四个实验,符合如图所示图象的是( )
某课外兴趣小组的同学所做的下列四个实验,符合如图所示图象的是( )