题目内容
【题目】如图是a、b、c三种固体物质的溶解度曲线:请回答下列问题:
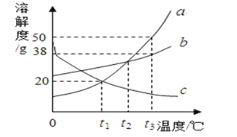
(1)t1℃时a物质的饱和溶液中溶液质量与溶剂质量的比(最简比)_____。
(2)三种物质的结晶方法与海水晒盐相同的是_____(填“a”“b”或“c”)
(3)t3℃时,把20ga、b、c三种物质分别加入盛有50g水的烧杯中不断搅拌,充分溶解后恢复至t3℃,所得溶液的溶质质量分数大小关系为__(填字母,下同)再将溶液降低到t1℃时所得溶液质量大小关系为__。
(4)t1℃时a、b、c三种物质的饱和溶液同时升温到t2℃此时溶液中溶质的质量分数大小关系是_____。
【答案】6:5 b a>b>c b>a=c b>a>c
【解析】
(1)根据溶解度的概念计算;
(2)根据溶解度曲线的意义分析;
(3)根据三种物质在不同温度时的溶解度分析;
(4)根据饱和溶液升高温度溶质质量分数的变化分析。
(1)t1℃时a物质的溶解度为20g,a物质的饱和溶液中溶液质量与溶剂质量的比为:(100g+20g):100g=6:5
(2)a、b两种固体物质的溶解度,都是随温度升高而增大,而c的溶解度随温度的升高而减少;三种物质的结晶方法中与海水晒盐相同的是b,因为b的溶解度受温度的影响变化不大;
(3)t3℃时,把20克 a、b、c三种物质分别加入到盛有50克水的烧杯中不断搅拌,所得溶液的溶质质量分数大小关系:a>b>c,因为在该温度下a的溶解度最大是50g,物质a完全被溶解,b的溶解度是38g,物质b未溶解了,物质c剩余最多;若将温度降低到t1℃时,溶液质量的大小关系为b>a=c,因为a降温后析出固体比b多,c又溶解一部分固体,该温度下,b的溶解度最大,a与c的溶解度相等,溶质的质量分数相等;
(4)t1℃时a、b、c三种物质的饱和溶液中溶质质量分数大小为b>a=c,三种物质的饱和溶液同时升温到t2℃,a、b物质的溶解度增大,c物质的溶解度减小,此时溶液中溶质的质量分数大小关系是b>a>c。

 阅读快车系列答案
阅读快车系列答案【题目】分类、类比是学习化学常用的方法。
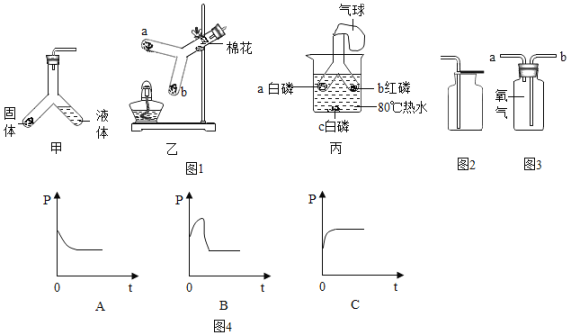
(1)初中化学实验可以按照实验目的分为:“物质含量的探究”、“探究反应条件实验”、“探究物质性质实验”等。据此我们可以将实验D 与实验①_____(填字母)分为一类,分类依据是②_____。
|
|
|
|
A | B | C | D |
(2)浓硫酸、稀硝酸和浓硝酸能和某些金属活动性弱的金属发生反应,如金属银能与稀硝酸、浓硝酸发生反应,其发生反应的化学方程式如下:3Ag+4HNO3(稀)=3AgNO3+NO↑+2H2O ,Ag+2HNO3(浓)═AgNO3+NO2↑+H2O金属铜也能与稀硝酸、浓硝酸发生类似的反应,结合上述信息,试写出铜与浓硝酸发生反应的化学方程式:①_____。在铜与浓硝酸的反应中,元素化合价发生改变的元素是②__(填元素符号)