题目内容
水和以水为溶剂制成的溶液与人们的生活有着密切的关系.
(1)近几年我国不少水域多次发生严重的“赤潮”、“水华”现象.“赤潮”、“水华”主要是水面上的藻类疯狂生长、繁殖,水质恶化.已知某种藻类的化学式为C106H263O110N16P,该物质分子中碳、氧原子个数比
(2)配制100g生理食盐水(溶质的质量分数是0.9%)需要水的质量是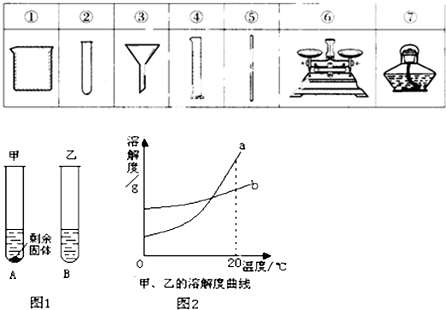
配制溶液过程中需要用到以上仪器
配制溶液过程中可能导致溶液的溶质质量分数偏小的因素为
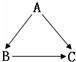
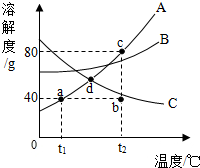
(3)20℃时,分别向盛有10g水的两支试管中,加入等质量的甲、乙两种固体物质,使其充分溶解,观察到如图1所示的现象.
①20℃时,
②图2中表示甲物质的溶解度曲线的是
(1)近几年我国不少水域多次发生严重的“赤潮”、“水华”现象.“赤潮”、“水华”主要是水面上的藻类疯狂生长、繁殖,水质恶化.已知某种藻类的化学式为C106H263O110N16P,该物质分子中碳、氧原子个数比
53:55
53:55
.(2)配制100g生理食盐水(溶质的质量分数是0.9%)需要水的质量是
99.1g
99.1g
. 
配制溶液过程中需要用到以上仪器
①④⑤⑥
①④⑤⑥
.(填序号)配制溶液过程中可能导致溶液的溶质质量分数偏小的因素为
氯化钠不纯;烧杯内壁上残留有清洗烧杯留下的蒸馏水
氯化钠不纯;烧杯内壁上残留有清洗烧杯留下的蒸馏水
.(举两例)(3)20℃时,分别向盛有10g水的两支试管中,加入等质量的甲、乙两种固体物质,使其充分溶解,观察到如图1所示的现象.
①20℃时,
A
A
(填“A”或“B”)试管中的溶液一定是饱和溶液;②图2中表示甲物质的溶解度曲线的是
b
b
.(填“a”或“b”),使A试管中剩余的固体继续溶解可以采用的方法是升高温度
升高温度
.分析:(1)根据藻类的化学式为Cl06H263O110N16P中原子个数进行计算;
(2)利用一定量溶液中溶质质量=溶液质量×溶液中溶质的质量分数,再溶液、溶质和溶剂质量之间的关系计算即可;
配制100g 0.9%的NaCl溶液所需进行的操作过程为计算-称量-溶解,根据过程中操作所需要使用的仪器,判断所列仪器是否需要;
导致溶液中氯化钠的质量分数大于0.9%的原因可能是:称量溶质称多了,量取水时量少了(量水时俯视读数);
(3)根据饱和溶液的含义分析溶液的饱和、不饱和,根据20℃时溶解度大小分析甲、乙的溶解度曲线,根据甲物质的溶解度随温度的变化情况分析要使试管中剩余的甲固体继续溶解可采用的方法.
(2)利用一定量溶液中溶质质量=溶液质量×溶液中溶质的质量分数,再溶液、溶质和溶剂质量之间的关系计算即可;
配制100g 0.9%的NaCl溶液所需进行的操作过程为计算-称量-溶解,根据过程中操作所需要使用的仪器,判断所列仪器是否需要;
导致溶液中氯化钠的质量分数大于0.9%的原因可能是:称量溶质称多了,量取水时量少了(量水时俯视读数);
(3)根据饱和溶液的含义分析溶液的饱和、不饱和,根据20℃时溶解度大小分析甲、乙的溶解度曲线,根据甲物质的溶解度随温度的变化情况分析要使试管中剩余的甲固体继续溶解可采用的方法.
解答:解:(1)由藻类的化学式为Cl06H263O110N16P可知,C、O原子的个数比为106:110=53:55;
故答案为:53:55;
(2)要配制100g溶质的质量分数为0.9%生理食盐水,需要氯化钠的质量为100g×0.9%=0.9g,故所需水的质量为100g-0.9g=99.1g;
托盘天平用于称取固体氯化钠、量筒用于量取溶剂水、烧杯用于溶解、胶头滴管辅助于量取水、玻璃棒用于溶解时的搅拌.所以需要的仪器是:①④⑤⑥;
氯化钠不纯,导致溶解氯化钠质量偏小,所配制氯化钠溶液的质量分数偏小;
烧杯内壁上残留有清洗烧杯留下的蒸馏水,水的体积因此而偏大,所配制氯化钠溶液的质量分数偏小;
量取水时仰视读数,读数小于所量取水的实际体积,使量取水的体积偏大,所配制氯化钠溶液的质量分数偏小等等;
故答案是:99.1g;①④⑤⑥;氯化钠不纯,烧杯内壁上残留有清洗烧杯留下的蒸馏水;
(3)由图示1可知,A物质的溶液不能再溶解甲物质了,所以是饱和溶液,由图2所示,20℃时,溶解度曲线b位于溶解度曲线a下方,表明此时a的溶解度大于b;图1所示物质B全部溶解而物质A有固体物质剩余,说明此时B物质的溶解度大于A物质;因此,可得图2中b表示A物质的溶解度曲线;A物质的溶解度随温度的升高而增大,要使试管中剩余的A固体继续溶解可采用的方法是升高温度.
故答案是:A;b;升高温度.
故答案为:53:55;
(2)要配制100g溶质的质量分数为0.9%生理食盐水,需要氯化钠的质量为100g×0.9%=0.9g,故所需水的质量为100g-0.9g=99.1g;
托盘天平用于称取固体氯化钠、量筒用于量取溶剂水、烧杯用于溶解、胶头滴管辅助于量取水、玻璃棒用于溶解时的搅拌.所以需要的仪器是:①④⑤⑥;
氯化钠不纯,导致溶解氯化钠质量偏小,所配制氯化钠溶液的质量分数偏小;
烧杯内壁上残留有清洗烧杯留下的蒸馏水,水的体积因此而偏大,所配制氯化钠溶液的质量分数偏小;
量取水时仰视读数,读数小于所量取水的实际体积,使量取水的体积偏大,所配制氯化钠溶液的质量分数偏小等等;
故答案是:99.1g;①④⑤⑥;氯化钠不纯,烧杯内壁上残留有清洗烧杯留下的蒸馏水;
(3)由图示1可知,A物质的溶液不能再溶解甲物质了,所以是饱和溶液,由图2所示,20℃时,溶解度曲线b位于溶解度曲线a下方,表明此时a的溶解度大于b;图1所示物质B全部溶解而物质A有固体物质剩余,说明此时B物质的溶解度大于A物质;因此,可得图2中b表示A物质的溶解度曲线;A物质的溶解度随温度的升高而增大,要使试管中剩余的A固体继续溶解可采用的方法是升高温度.
故答案是:A;b;升高温度.
点评:根据物质的化学式可以表示物质元素的组成及分子的构成,利用物质的化学式可计算各元素的原子个数比;使用固体质配制溶液的操作过程为计算-称量-溶解;固体物质加入水中充分溶解后,溶液中仍有未溶解的固体溶质的溶液一定为该温度下的饱和溶液.

练习册系列答案
相关题目
水和以水为溶剂制成的溶液,与人们的生活有着密切的关系。
(1)生理盐水中的溶剂是 。
(2)市售的一种罐装饮料,在饮料罐的夹层中分别装入一种固体物质和水,饮用前摇动饮料罐使它们混合,饮料温度就会降低,这种固体物质可能是 (填字母)。
A.烧碱 B.食盐 C.硝酸铵 D.生石灰
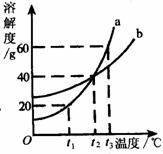
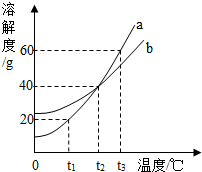
(3)右图为a、b两种固体物质的溶解度曲线,请依据曲线图回答问题:
①在t3℃时,50g水中最多能够溶解a物质的质量是 ;
②在 ℃时,a物质的饱和溶液和b物质的饱和溶液中,溶质的质量分数相等。
③把100g质量分数为20%的a溶液从t3℃降温到t2℃,此时a溶液的质量分数是 。
(4)现有一瓶浓硫酸,标签如图所示。欲将该瓶浓硫酸完全稀释成20%的稀硫酸,需要水的质量是 g。
|

 (2013?塘沽区一模)水和以水为溶剂制成的溶液,与人们的生活有着密切的关系.
(2013?塘沽区一模)水和以水为溶剂制成的溶液,与人们的生活有着密切的关系.
