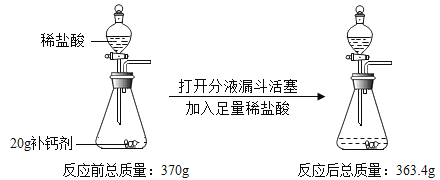
题目内容
【题目】水是生命之源,是人类生活的基础。
(1)保持水的化学性质的最小微粒是____(填化学式)。
(2)实验室中水除了可用作溶剂之外,水还有的用途是___(写一种)。
(3)如图所示是 a、b、c、三种物质在水中的溶解度曲线。
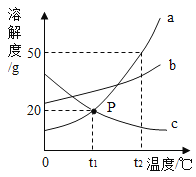
①b 溶液在 P 点处于____(填“饱和”或“不饱和”)状态。
②t2℃时,50 g 水中最多能溶解 a 物质______g。
③将t2℃时 a、b、c、三种物质的饱和溶液降温至t1℃,下列说法正确的是__(填字母序号)。
A 溶质质量分数:b>a>c
B 析出固体的质量 a>b,c 无固体析出
C 溶剂的质量 a<b<c
D a、b 的溶液是饱和溶液,c 的溶液是不饱和溶液
【答案】H2O 洗涤仪器或作反应物 不饱和 25 AD
【解析】
(1)水是由水分子构成的,所以保持水的化学性质的最小微粒是水分子,其化学式为H2O,故填H2O。
(2)实验室中水除了可用作溶剂之外,还可以用来洗涤仪器,还能在与氧化钙等物质发生的化学反应中作反应物,故填洗涤仪器或作反应物。
(3)①溶解度曲线下方的点所对应的溶液是然找的不饱和溶液,P点在b的溶解度曲线下方,所以b 溶液在 P 点处于不饱和状态,故填不饱和;
②由图可知,t2℃时,a物质的溶解度为50g,即t2℃时,100g水中最多溶解50ga,所以t2℃时,50 g 水中最多能溶解25g a 物质,故填25;
③A 由图可知,a、b的溶解度均随温度升高而增大,且t1℃时b的溶解度大于a的溶解度,所以将 t2℃时 a、b两种物质的饱和溶液降温至 t1℃时,两种物质的溶解度均变小且溶液均为t1℃时的饱和溶液,并且两种物质的溶液的溶质质量分数的关系为b>a,由图可知,c的溶解度随温度升高而减小,且t2℃时c的溶解度小于t1℃时a的溶解度,将 t2℃时 c的饱和溶液降温至 t1℃时,c的溶解度增大,溶液变为不饱和溶液,并且溶液的溶质质量分数不变,所以此时a、c溶液的溶质质量分数的关系为a>c,因此将 t2℃时 a、b、c、三种物质的饱和溶液降温至 t1℃,三种物质的溶液的溶质质量分数的关系为:b>a>c,选项正确;
B 由图可知,a、b的溶解度均随温度升高而增大,所以将 t2℃时 a、b两种物质的饱和溶液降温至 t1℃时,两种物质的溶解度均变小,都有晶体析出,但题目中没有指明两种溶液的质量关系,所以无法判断析出晶体的质量关系,选项错误;
C 题目中没有指明三种溶液的质量关系,无法确定其中的溶剂的质量关系,选项错误;
D 由图可知,a、b的溶解度均随温度升高而增大,所以将 t2℃时 a、b两种物质的饱和溶液降温至 t1℃时,两种物质的溶解度均变小且溶液均为t1℃时的饱和溶液,c的溶解度随温度升高而减小,则将 t2℃时 c的饱和溶液降温至 t1℃时,c的溶解度增大,溶液变为不饱和溶液,选项正确,故填AD。

【题目】纸张中含有什么元素?小明和小亮进行了探究.
[提出问题]纸张中含有什么元素呢?
[猜想假设]纸张中可能含有碳元素和氢元素.
[查阅资料]①纸张燃烧后,如果生成物中含有碳元素、氢元素,则该纸张中一定含碳元素、氢元素;
②二氧化碳气体可以使澄清的石灰水变浑浊.
[实验探究]
(1)仪器和用品:冷而干燥的烧杯、蜡烛、火柴、澄清的石灰水.
(2)实验过程:
实验步骤 | 实验现象 | 实验结论 |
①_______ | _______ | 由步骤①可知纸张中一定含有 |
②_______ | _______ | 由步骤②可知纸张中一定含有碳元素 |
【题目】化学世界神奇“多变”,在学习常见的盐的化学性质后,某化学兴趣学习小组完成了如下实验。该学习小组对废液杯上层清液的溶质的成分进行了探究。请完成以下探究过程。
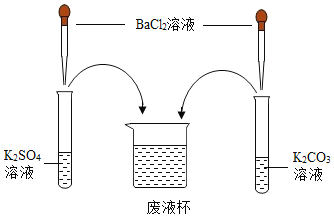
(提出问题)上层清液中含有什么溶质?
(作出猜想)Ⅰ、溶质仅为____________;
Ⅱ、溶质为 KCl 和 BaCl2;
Ⅲ、溶质为KCl 和____________________;
Ⅳ、溶质为KCl 和 K2CO3;
Ⅴ、溶质为 KCl、K2SO4 和 K2CO3。
(设计方案)
实验操作 | 现象 | 结论 | |
取少量废液杯中上层清液,分装于甲、乙两支试管中 | 先向甲试管中滴加 少量的_____________溶液 | 有白色沉淀产生 | 猜想Ⅰ、Ⅱ 均不正确 |
再向乙试管中滴加适量稀盐酸 | _________ | 猜想Ⅲ 不正确 | |
(继续探究)小花同学最终通过以下实验确定Ⅴ正确。实验方案如下:直接对上述甲试管实验后的悬浊液进行过滤,取少量滤渣于另一支试管中,__________(请将操作、现象补充完整)。
(交流反思)学习小组经讨论认为:实验过程中无须检验 KCl,其理由是_________(请用文字表述)。
【题目】某同学对“影响稀盐酸和大理石反应快慢的因素”进行探究.选取的药品:成分相同的粉末状大理石、块状大理石两种样品;浓度为16%、9%的稀盐酸.采用控制变量法设计实验方案,以5分钟内收集到CO2的质量作为判断依据.已知稀盐酸足量且样品中杂质不与稀盐酸反应,实验装置如图.读取电子天平的示数,据此计算生成的CO2的质量,记录的数据如表
实验序号 | 大理石 (各6g) | 稀盐酸的浓度 | 反应开始到5分钟产生CO2的质量 | 反应结束产生的CO2的质量 |
① | 块状 | 16% | 2.16g | 2.2g |
② | 块状 | 9% | 1.42g | 2.2g |
③ | 粉末 | 16% | 2.33g | 2.2g |
④ | 粉末 | 9% | 1.93g | m2 |
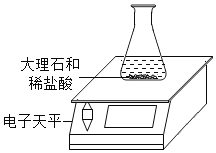
(1)稀盐酸的浓度对该反应快慢的影响:_____.
(2)实验过程中,通过观察如图装置中的哪一现象可判断反应结束_____.
(3)结合表格分析,实验④反应结束后m2的值_____.
(4)探究大理石的颗粒大小对该反应快慢的影响,其实验序号分别是_____.
(5)计算该大理石(6g)样品中含碳酸钙的质量为_____.
【题目】某同学取硫酸钠和硫酸镁固体混合物26.2g,向其中加入219.6g水,使其完全溶解配制成溶液。将200g一定溶质质量分数的氢氧化钠溶液平均分成5等份,依次加入到上述溶液中,生成沉淀的质量与加入氢氧化钠溶液的质量关系如下表:
氢氧化钠溶液加入量/g | 第一次加入40 | 第二次加入40 | 第三次加入40 | 第四次加入40 | 第五次加入40 |
产生沉淀质量/g | 1.45 | 2.9 | m | 5.8 | 5.8 |
计算:(1)m的值为_____。
(2)固体混合物中硫酸镁的质量。
(3)恰好完全反应时,所得不饱和溶液中溶质的质量分数。