题目内容
(2009?成都)某化学实验小组拟用以下装置进行气体制备的研究.
(1)以KClO3为原料制O2时,应选装置______(填字母序号);化学方程式为______△2KCl+3O2↑
【答案】分析:(1)根据反应物的状态和反应条件确定发生装置,熟记常用的化学方程式.
(2)熟记常用的化学方程式;根据盐酸的挥发性和酸碱指示剂遇酸碱溶液的变色情况进行分析.
(3)气体的收集装置主要由气体的密度和溶水性决定.
(4)从操作是否简单、是否节约药品、是否方便使用、是否会造成污染等角度进行分析.
解答:解:(1)反应物的状态是固态,反应条件是加热,应选固-固加热型的发生装置;氯酸钾以二氧化锰为催化剂加热生成氯化钾和氧气.故答案为:A; 2KClO3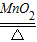 2KCl+3O2↑
2KCl+3O2↑
(2)碳酸钙和盐酸反应生成氯化钙、水和二氧化碳;盐酸具有挥发性,能挥发出氯化氢气体,所以制得的二氧化碳中混有少量的氯化氢气体,氯化氢气体也能使紫色的石蕊溶液变成红色.故答案为:CaCO3+2HCl=CaCl2+H2O+CO2↑; 不可行;制得的气体中除二氧化碳外,还有少量HCl,HCl也可使紫色的石蕊溶液变红.
(3)D装置中装满水,用此装置收集气体的方法叫排水法,能用排水法收集的气体必须满足的条件是:不溶于水且不与水发生反应,氧气不易溶于水,且不与水发生反应,可用此装置收集.故答案为:氧气.
(4)通过分液漏斗添加液体药品,能够控制液体药品的滴加速度.故答案为:能够通过活塞控制稀盐酸滴入的速率,使碳酸钠和稀盐酸的反应速率适中.
点评:本道题主要考查了气体发生装置和气体收集装置的选取,气体发生装置主要由反应物的状态和反应条件决定,气体的收集装置主要由气体的密度和溶水性决定,另外还要考虑气体是否与水反应、是否与空气反应、是否会污染空气等等.
(2)熟记常用的化学方程式;根据盐酸的挥发性和酸碱指示剂遇酸碱溶液的变色情况进行分析.
(3)气体的收集装置主要由气体的密度和溶水性决定.
(4)从操作是否简单、是否节约药品、是否方便使用、是否会造成污染等角度进行分析.
解答:解:(1)反应物的状态是固态,反应条件是加热,应选固-固加热型的发生装置;氯酸钾以二氧化锰为催化剂加热生成氯化钾和氧气.故答案为:A; 2KClO3
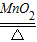 2KCl+3O2↑
2KCl+3O2↑(2)碳酸钙和盐酸反应生成氯化钙、水和二氧化碳;盐酸具有挥发性,能挥发出氯化氢气体,所以制得的二氧化碳中混有少量的氯化氢气体,氯化氢气体也能使紫色的石蕊溶液变成红色.故答案为:CaCO3+2HCl=CaCl2+H2O+CO2↑; 不可行;制得的气体中除二氧化碳外,还有少量HCl,HCl也可使紫色的石蕊溶液变红.
(3)D装置中装满水,用此装置收集气体的方法叫排水法,能用排水法收集的气体必须满足的条件是:不溶于水且不与水发生反应,氧气不易溶于水,且不与水发生反应,可用此装置收集.故答案为:氧气.
(4)通过分液漏斗添加液体药品,能够控制液体药品的滴加速度.故答案为:能够通过活塞控制稀盐酸滴入的速率,使碳酸钠和稀盐酸的反应速率适中.
点评:本道题主要考查了气体发生装置和气体收集装置的选取,气体发生装置主要由反应物的状态和反应条件决定,气体的收集装置主要由气体的密度和溶水性决定,另外还要考虑气体是否与水反应、是否与空气反应、是否会污染空气等等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
(2009?成都)下表是某同学归纳整理的复习资料.其中错误的是( )
|
(2009?成都)为了测定实验室某生锈铁片中铁元素的质量分数,两位同学分别设计了如下甲、乙两个实验方案.
方案甲:称得生锈铁片的质量为m1g,按图Ⅰ所示装置进行实验.完全反应后,测得室温下产生氢气的体积为V1L,查得其密度为
ρ1g/L.方案乙:称得生锈铁片的质量为m2g,先按图Ⅱ所示装置进行实验.当生锈铁片完全变成光亮的银白色时,停止加热,继续通入CO至室温.取出铁片,按图Ⅰ所示装置继续进行实验.完全反应后,测得室温下产生氢气的体积为V2L,查得其密度为
ρ2g/L.

(1)称量是,应将铁片放在托盘天平的______盘(填“左”或“右”);两位同学使用托盘天平,分别称得铁片质量为
2.12g、2.1g,其中不合理的数据是______.
(2)评价交流:上述两个方案中,可行的是______(填“甲”或“乙”);分析不可行方案,其缺陷是______.
(3)设计实验:方案乙中,同学们设计了如下实验报告,请帮助完成.
2Fe+3CO2
方案甲:称得生锈铁片的质量为m1g,按图Ⅰ所示装置进行实验.完全反应后,测得室温下产生氢气的体积为V1L,查得其密度为
ρ1g/L.方案乙:称得生锈铁片的质量为m2g,先按图Ⅱ所示装置进行实验.当生锈铁片完全变成光亮的银白色时,停止加热,继续通入CO至室温.取出铁片,按图Ⅰ所示装置继续进行实验.完全反应后,测得室温下产生氢气的体积为V2L,查得其密度为
ρ2g/L.

(1)称量是,应将铁片放在托盘天平的______盘(填“左”或“右”);两位同学使用托盘天平,分别称得铁片质量为
2.12g、2.1g,其中不合理的数据是______.
(2)评价交流:上述两个方案中,可行的是______(填“甲”或“乙”);分析不可行方案,其缺陷是______.
(3)设计实验:方案乙中,同学们设计了如下实验报告,请帮助完成.
| 实验编号 | 实验步骤 | 实验现象 | 结论或化学方程式 |
① 装置Ⅱ | 通入CO,加热.完全反应后,停止加热,继续通CO至室温 | 生锈铁片变成光亮的银白色 | CO具有______性;反应结束后,还要继续通CO至室温的目的是______ 化学方程式:______ |
(2009?成都)自然界中,铜多存在于矿石中.如:
(1)辉铜矿中,铜的质量分数应______80%(填”>”、”<”或”=”).
(2)铜在潮湿的空气中易生成铜绿 CuCO3?Cu(OH)2.为了除去铜器表面的铜绿,某同学提出以下三种方案:
Ⅰ用水洗Ⅱ用稀盐酸洗Ⅲ加热
仔细查阅上表资料,上述方案最可行的是______(填序号代码)
(3)根据化学方程式计算:加热2.22g CuCO3?Cu(OH)2,使之完全分解,计算剩余固体的质量.
(4)工业上以黄铜矿为原料生产铜时会产生SO2尾气.将SO2直接排放到大气中,溶于雨水会形成______; 处理该尾气一般是将SO2循环制备成H2SO4,用氨水吸收.H2SO4,与氨水反应生成的铵盐是一种常见氮肥,该盐是______(写化学式或名称).
| 矿石成分 | 辉铜矿 | 孔雀石 | 黄铜矿 |
| 主要成分 | Cu2S | CuCO3?Cu(OH)2 | CuFeS2 |
(2)铜在潮湿的空气中易生成铜绿 CuCO3?Cu(OH)2.为了除去铜器表面的铜绿,某同学提出以下三种方案:
Ⅰ用水洗Ⅱ用稀盐酸洗Ⅲ加热
仔细查阅上表资料,上述方案最可行的是______(填序号代码)
(3)根据化学方程式计算:加热2.22g CuCO3?Cu(OH)2,使之完全分解,计算剩余固体的质量.
(4)工业上以黄铜矿为原料生产铜时会产生SO2尾气.将SO2直接排放到大气中,溶于雨水会形成______; 处理该尾气一般是将SO2循环制备成H2SO4,用氨水吸收.H2SO4,与氨水反应生成的铵盐是一种常见氮肥,该盐是______(写化学式或名称).