题目内容
(2009?成都)自然界中,铜多存在于矿石中.如:| 矿石成分 | 辉铜矿 | 孔雀石 | 黄铜矿 |
| 主要成分 | Cu2S | CuCO3?Cu(OH)2 | CuFeS2 |
(2)铜在潮湿的空气中易生成铜绿 CuCO3?Cu(OH)2.为了除去铜器表面的铜绿,某同学提出以下三种方案:
Ⅰ用水洗Ⅱ用稀盐酸洗Ⅲ加热
仔细查阅上表资料,上述方案最可行的是______(填序号代码)
(3)根据化学方程式计算:加热2.22g CuCO3?Cu(OH)2,使之完全分解,计算剩余固体的质量.
(4)工业上以黄铜矿为原料生产铜时会产生SO2尾气.将SO2直接排放到大气中,溶于雨水会形成______; 处理该尾气一般是将SO2循环制备成H2SO4,用氨水吸收.H2SO4,与氨水反应生成的铵盐是一种常见氮肥,该盐是______(写化学式或名称).
【答案】分析:(1)根据硫化亚铜的化学式进行计算;
(2)根据铜绿的组成和性质判断清除方法,铜绿中含有碳酸根和氢氧根,可以与稀盐酸反应;
(3)根据铜绿分解的化学方程式进行计算;
(4)二氧化硫与水反应生成亚硫酸,氨水和硫酸反应生成硫酸铵.
解答:解:(1)硫化亚铜中,铜的质量分数应=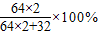 =80%,但在辉铜矿中除了硫化亚铜还含有其他一些不含铜元素的杂质,故辉铜矿中铜的质量分数小于80%;
=80%,但在辉铜矿中除了硫化亚铜还含有其他一些不含铜元素的杂质,故辉铜矿中铜的质量分数小于80%;
(2)因为铜绿不溶于水,故不能用水清洗,铜绿能和盐酸反应生成可溶性铜盐,故可用盐酸清洗,铜绿加热时生成氧化铜,故也不能完全除去,因此选择方案Ⅱ;
(3)设加热2.22g CuCO3?Cu(OH)2,使之完全分解,生成氧化铜的质量为x
CuCO3?Cu(OH)2 2CuO+H2O+CO2↑
2CuO+H2O+CO2↑
222 160
2.22g x
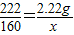
x=1.6g
答:剩余固体的质量为1.6g
(4)二氧化硫与水反应生成亚硫酸,氨水和硫酸反应生成硫酸铵.
故答案为:(1)<
(2Ⅱ
(3)1.6g.
(4)H2SO3; 硫酸铵或(NH4)2SO4
点评:解答本题的关键是要掌握化学方程式的书写方法、根据化学方程式的计算及其各种物质的性质方面的知识,只有这样才能对问题做出正确的判断.
(2)根据铜绿的组成和性质判断清除方法,铜绿中含有碳酸根和氢氧根,可以与稀盐酸反应;
(3)根据铜绿分解的化学方程式进行计算;
(4)二氧化硫与水反应生成亚硫酸,氨水和硫酸反应生成硫酸铵.
解答:解:(1)硫化亚铜中,铜的质量分数应=
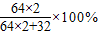 =80%,但在辉铜矿中除了硫化亚铜还含有其他一些不含铜元素的杂质,故辉铜矿中铜的质量分数小于80%;
=80%,但在辉铜矿中除了硫化亚铜还含有其他一些不含铜元素的杂质,故辉铜矿中铜的质量分数小于80%;(2)因为铜绿不溶于水,故不能用水清洗,铜绿能和盐酸反应生成可溶性铜盐,故可用盐酸清洗,铜绿加热时生成氧化铜,故也不能完全除去,因此选择方案Ⅱ;
(3)设加热2.22g CuCO3?Cu(OH)2,使之完全分解,生成氧化铜的质量为x
CuCO3?Cu(OH)2
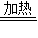 2CuO+H2O+CO2↑
2CuO+H2O+CO2↑222 160
2.22g x
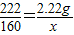
x=1.6g
答:剩余固体的质量为1.6g
(4)二氧化硫与水反应生成亚硫酸,氨水和硫酸反应生成硫酸铵.
故答案为:(1)<
(2Ⅱ
(3)1.6g.
(4)H2SO3; 硫酸铵或(NH4)2SO4
点评:解答本题的关键是要掌握化学方程式的书写方法、根据化学方程式的计算及其各种物质的性质方面的知识,只有这样才能对问题做出正确的判断.

练习册系列答案
相关题目