题目内容
【题目】用化学用语表示:
(1)2个镁离子_______________;(2)氢氧化亚铁______________;
(3)保持二氧化硫的化学性质的最小粒子_______________。
【答案】 2Mg2+ Fe(OH)2 SO2
【解析】(1)镁离子为Mg2+,则2个镁离子为2Mg2+;
(2)氢氧化亚铁中铁为-2价,氢氧根为-1价,则其化学式为Fe(OH)2 ;
(3)分子是保持物质化学性质的最小微粒,则保持二氧化硫的化学性质的最小粒子是SO2。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】草酸镍晶体(NiC2O4·2H2O)可用于制镍催化剂。某小组用废镍催化剂(成分为Fe2O3、Ni、Fe、SiO2等)制备草酸镍晶体的部分实验流程如下:
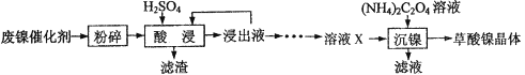
已知:①Ni能和稀H2SO4反应。
②相关金属离子生成氢氧化物沉淀的pH如下表:
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Ni2+ | 6.7 | 9.5 |
③H2O2能将Fe2+氧化为Fe3+
(1)废镍催化剂“粉碎”的目的是______。
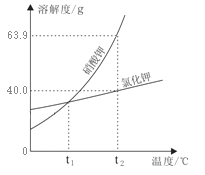
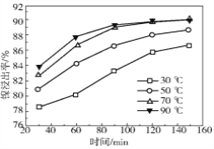
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图,“酸浸”的适宜温度与时间分别为 _______(填字母)。
A.30℃、30min B.90℃、150min C.70℃、120min D.90℃、120min
(3)“酸浸”中发生的复分解反应方程式为________。
(4)“浸出液”得到“溶液x”过程中,加入试剂先后顺序是_____(填字母)。
A.先加H2O2溶液,再加NaOH溶液 B.先加NaOH溶液,再加H2O2溶液
加NaOH溶液调节pH_____(填范围),充分反应后得到滤渣的操作是______,该操作中所用到的玻璃仪器有玻璃棒、烧杯和_________。
(5)将“沉镍”工序:①主要过程为:蒸发浓缩、_____ 、过滤,所得固体用75%乙醇洗涤、110℃下烘干,得草酸镍晶体。
②用75%乙醇洗涤的目的是洗去杂质、___________;
③烘干温度不超过110℃的原因是______。
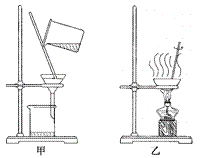
【题目】(一)实验课上,甲组同学运用下列实验方法探究碱的性质。
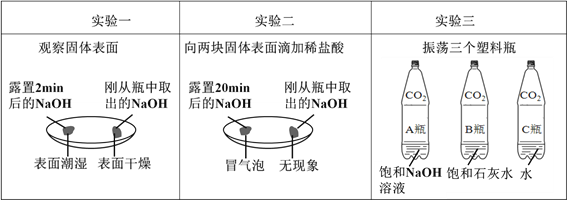
①由上图实验一可知,氢氧化钠会吸收空气中的_______,此变化过程属于____ (填“物理变化”或“化学变化”)。
②由上图实验二可知,氢氧化钠会吸收空气中的______而变质,因此要密封保存。
②实验三中可观察到三个软塑料瓶变瘪的程度大小为A>B>C,对比A瓶与____ (选填“B”或“C”)瓶的实验现象可证明CO2 能与NaOH发生反应。
(二)乙组同学设计了如图所示的装置中,集气瓶内充满二氧化碳气体,瓶口的双孔塞一孔插一根连接气球的玻璃管,另一孔插一支盛有氢氧化钠溶液的胶头滴管。把胶头滴管中的氢氧化钠溶液滴入瓶中,振荡。

①实验现象:________________________,
反应的化学方程式为________________________;
②小明对瓶底残留液的成分产生了兴趣,欲探究其中是否含有碳酸钠:
实验操作 | 实验现象 | 实验结论 | |
方法1 | 取样,滴加稀盐酸 | ______ | 含有碳酸钠 |
方法2 | 取样,滴加氢氧化钙溶液 | 产生_______ |
小明又取样于试管中,滴加无色酚酞试液,酚酞变红,由此也得出瓶底残留液中只含有碳酸钠的结论。稍后想想又立即否定了自己的结论,理由是_______________。