题目内容
【题目】金属材料在生产和生活中有广泛的应用,人类每年要从自然界获取大量的金属资源。
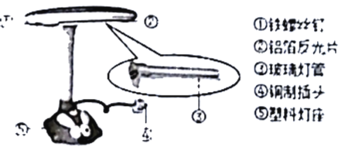
(1)图中标识的各部件中,用金属材料制成的是___(填序号),铜制插头利用了铜的___性。
(2)全世界每年因锈蚀损失的钢铁,约占世界年产量的20%~40%。铁的锈蚀,实际是铁与空气中的氧气、___发生化学反应的过程。除去铁制品表面的铁锈可用稀硫酸,反应的化学方程式为___。
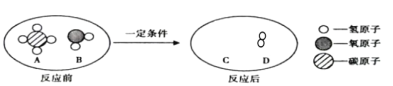
(3)已知①X+YSO4═XSO4+Y;②Z+YCl2=Y+ZCl2;③Z+2HCl═ZCl2+H2↑,且X不与盐酸反应。由此推断三种金属的活动性由弱到强的顺序是_____。
(4)现有铁与另一种金属A的混合物(A可能是铝、镁或铜)。
①取5.6g该混合物与足量的稀盐酸反应生成0.18g氢气,则金属A是_____。
②若取一定量的原混合物投入一定量的AgNO3溶液中,充分反应后过滤,得到滤液和滤渣,则滤液中可能含有的溶质化学式是_____。
【答案】①②④ 导电 水蒸气 ![]() Z>X>Y 铜 Cu(NO3)2、AgNO3
Z>X>Y 铜 Cu(NO3)2、AgNO3
【解析】
(1)图中标识的各部件中,①铁螺丝钉含有金属铁,由金属材料制成,②铝箔反光片含有金属铝,由金属材料制成,③玻璃灯管由玻璃制成,玻璃不属于金属材料,④铜制插头含有金属铜,由金属材料制成,⑤塑料灯座由塑料制成,塑料不属于金属材料,故用金属材料制成的是①②④;铜制插头能够导电利用了铜的导电性。
(2)铁的锈蚀实际是铁与空气中的氧气、水蒸气发生化学反应的过程。铁锈的主要成分是三氧化二铁,除去铁制品表面的铁锈可用稀硫酸,三氧化二铁与稀硫酸反应生成硫酸铁和水,反应的化学方程式为![]() 。
。
(3)活动性强的金属能够将活动性弱的金属从其盐溶液中置换出来,①X+YSO4═XSO4+Y;说明活动性X>Y;②Z+YCl2=Y+ZCl2,说明活动性Z>Y;③Z+2HCl═ZCl2+H2↑,且X不与盐酸反应,说明Z的活动性顺序在金属活动性顺序表氢元素之前,X的活动性顺序在金属活动性顺序表氢元素之后,则有活动性Z>X;由此推断三种金属的活动性由弱到强的顺序是Z>X>Y。
(4)由题意若是5.6g纯铁与稀盐酸反应,设产生氢气的质量为![]() ,则有:
,则有:
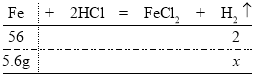
由![]() 解得
解得![]()
若是5.6g纯铝与稀盐酸反应,设产生氢气的质量为![]() ,则有:
,则有:
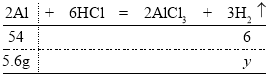
由![]() 解得
解得![]()
若是5.6g纯镁与稀盐酸反应,设产生氢气的质量为![]() ,则有:
,则有:
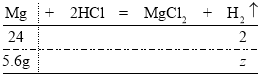
由![]() 解得
解得![]()
铜与稀盐酸不反应,不会产生氢气,取5.6g该混合物与足量的稀盐酸反应生成0.18g氢气,则混有的金属不会是镁和铝,因为这两种金属会导致产生的氢气的质量大于0.18g,故混有的金属是铜。
②若取一定量的原混合物投入一定量的AgNO3溶液中,则铁会与硝酸银反应生成硝酸亚铁和银,铜会与硝酸银反应生成硝酸铜和银,充分反应后过滤,得到滤液和滤渣,则滤液中一定含有硝酸亚铁,由于未知硝酸银溶液是否过量,因此根据以上反应关系判断可能含有的溶质是硝酸铜和硝酸银,化学式是Cu(NO3)2、AgNO3。