题目内容
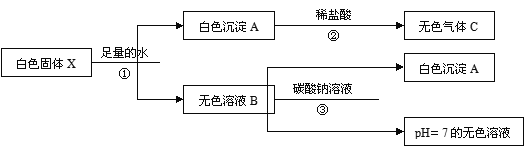
【题目】(5分)有一白色固体X,其主要成分是氯化钠,可能含有碳酸钙、氯化钙、硫酸铜和氢氧化钙中的一种或几种。为探究其组成进行如下实验,主要流程及现象记录如下:
【资料】氯化钙溶液呈中性,碳酸钠溶液呈碱性
回答下列问题:
(1)根据步骤①实验现象确定白色固体X中一定没有的物质是____________。
(2)步骤②中发生反应的化学方程式是____________________________________。
(3)步骤③中产生白色沉淀A的化学方程式是________________________________。
(4)白色固体X中的物质有____________。
(5)将白色固体X转化成氯化钠固体的实验方案是____________________________________。
【答案】(1)硫酸铜(2)CaCO3+2HCl=CaCl2+CO2↑+H2O
(3)CaCl2+Na2CO3=CaCO3↓+2NaCl
(4)氯化钠、碳酸钙和氯化钙
(5)取白色固体X于烧杯中,加足量水溶解,再加入适量的碳酸钠溶液,过滤,将滤液蒸干,便可得到氯化钠固体
【解析】
试题分析:步骤①加水溶液的颜色是无色的所以原物质中一定没有硫酸铜,其中的沉淀是碳酸钙会和盐酸反应产生二氧化碳气体,最终的溶液呈现中性说明原物中没有氢氧化钙。加入碳酸钠后产生沉淀说明原物中还有氯化钙。

练习册系列答案
相关题目