题目内容
【题目】(1)为延长食品保质期,常在食品中添加苯甲酸(C6H5COOH)作为防腐剂。回答下列问题:①苯甲酸是由 种元素组成;②苯甲酸中碳元素与氢元素的质量比为 (最简整数比)。
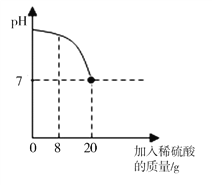
(2)小明称取黄铜(铜锌合金)样品10.0克,再用100.0克稀硫酸溶液逐滴滴入,测得实验数据如图所示。

求:
①该铜锌合金中,铜和锌的质量比是 (最简整数比)。
②所用稀硫酸溶液中溶质的质量分数是多少?
【答案】(1)三(或 3 );②14:1;(2)①7:13;② 19.6%
【解析】(1)①根据苯甲酸化学式的含义进行分析解答.
②根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答;
(2)根据质量守恒定律结合图像与化学方程式解答。
解:(1)①由苯甲酸的化学式可知,苯甲酸是由碳、氢、氧三种元素组成的;
②苯甲酸中碳元素与氢元素的质量比为(12×7):(6×1)=14:1;
(2)①由图可知,当加入稀硫酸的质量为50g时,剩余物质的质量为59.8g,当加入稀硫酸的质量为100g时,剩余物质的质量为100.98g,由此可知,当增加50g稀硫酸时,剩余物质的质量也增加50g,即表示在加入50g稀硫酸时稀硫酸与样品中的锌已经反应完。生成氢气的质量=10g+50g-59.8g=0.2g。
设样品中锌的质量为x,消耗硫酸的质量为y。
Zn+ H2SO4 == ZnSO4 + H2↑
65 98 2
x y 0.2g
![]()
x=6.5g
y=9.8g
该铜锌合金中,铜和锌的质量比是(10g-6.5g):6.5g=7:13;
②所用稀硫酸溶液中溶质的质量分数是![]() =19.6%
=19.6%
答:所用稀硫酸溶液中溶质的质量分数是19.6%。

【题目】下表是KCl和KNO3在不同温度下的溶解度。下列说法不正确的是
温度/ ℃ | 20 | 30 | 40 | 50 | |
溶解度/g | KCl | 34.0 | 37.0 | 40.0 | 42.6 |
KNO3 | 31.6 | 45.8 | 63.9 | 85.5 | |
A. 35℃时,KCl的溶解度小于KNO3的溶解度
B. 40℃时, KCl饱和溶液的溶质质量分数为40%
C. 两种物质溶解度相等的温度在20~30℃之间
D. 50℃时,185.5g KNO3饱和溶液降温到20℃,析出53.9gKNO3 晶体
【题目】某兴趣小组的同学为了测定碳酸钠样品(只含有氯化钠,不含其它杂质)中碳酸钠的含量,取该混合物样品与适量稀盐酸恰好完全反应,有关实验数据见附表.
附表:实验数据
反应前 | 反应后 | |||
实验数据 | 烧杯的质量/g | 稀盐酸的质量/g | 混合物样品的质量/g | 烧杯和其中混合物的质量/g |
40.6 | 123.4 | 12 | 171.6 | |
(1)反应生成二氧化碳的质量为 g;
(2)反应后所得溶液的溶质质量分数是多少?(要有详细的计算过程)