题目内容
现有镁、铝两种金属分别与稀盐酸充分反应,生成相同质量的氢气,则可能的情况有
| A.等质量的镁、铝分别与足量的稀盐酸充分反应 |
| B.质量比为4︰3的镁、铝分别与足量的稀盐酸充分反应 |
| C.质量比为8︰9的镁、铝分别与足量的稀盐酸充分反应 |
| D.足量的镁、铝分别与等质量、等浓度的稀盐酸充分反应 |
BD
试题分析:Mg、Al 两种金属分别跟稀盐酸反应的化学方程式为:Mg+2HCl=MgCl2+H2↑,2Al+6HCl=2AlCl3+3H2↑,据此分析。
A、等质量的镁、铝与足量的盐酸反应时,金属均完全反应,设镁、铝的质量为m,则
Mg+2HCl=MgCl2+H2↑,2Al+6HCl=2AlCl3+3H2↑,
24 2 54 6
m
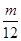 m
m 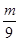
所以生成的氢气质量不等,错误;
B、质量比为4︰3的镁、铝分别与足量的稀盐酸充分反应时,金属均完全反应,设镁、铝的质量分别为4m和3m,则
Mg+2HCl=MgCl2+H2↑,2Al+6HCl=2AlCl3+3H2↑,
24 2 54 6
4m
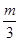 3m
3m 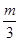
所以生成的氢气质量相等,正确;
C、根据B正确,可知C错误;
D、足量的镁、铝分别与等质量、等浓度的稀盐酸充分反应,则盐酸完全反应,由于反应生成的氢气全部来自盐酸中所含的氢元素,故得到的氢气的质量相同,正确。故选BD
点评:本题主要是利用化学方程式和假设法相结合方式解答问题,解答本题的关键是要明确:产生的氢气均来自于盐酸中的氢离子,故要得到相同质量的氢气,应有两种情况:参加反应的HCl的质量相等,或参与反应的Mg、Al的质量符合得到相同质量氢气的条件。

练习册系列答案
相关题目