题目内容
【题目】某实验小组要测定混有氯化钠的纯碱样品中Na2CO3的质量分数。取12g纯碱样品放入烧杯中,逐滴加入稀盐酸至恰好完全反应,共消耗稀盐酸72.4g,测得反应后溶液的质量为80g。请帮助实验小组完成以下计算:
(1)生成二氧化碳的质量为_____克;
(2)该纯碱样品中Na2CO3的质量分数;_____
(3)反应后所得溶液中溶质的质量分数是多少?_____
【答案】4.4 88.3% 16.4%
【解析】
(1)根据质量守恒定律,生成的二氧化碳的质量为:12g+72.4g﹣80g=4.4g。
(2)设样品中碳酸钠的质量为x,反应后生成氯化钠的质量为y
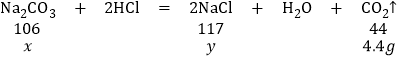
![]()
解得:x=10.6g,y=11.7g。
纯碱样品中Na2CO3的质量分数为:![]() ×100%≈88.3%;
×100%≈88.3%;
(3)反应后有氯化钠:11.7g+12g﹣10.6g=13.1g;故反应后溶质的质量分数为:![]() ×100%≈16.4%。
×100%≈16.4%。

 名校课堂系列答案
名校课堂系列答案【题目】元素周期表和化学用语都是学习化学的重要工具,回答下列问题
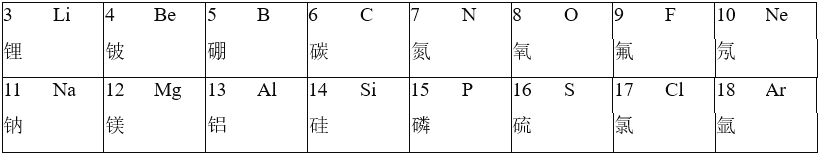
(1)第9号元素的气体单质(该物质的一个分子由两个原子构成)常温下与水发生反应,生成氢氟酸(HF)和另一种具有助燃性的常见气体单质,该反应的化学方程式为_____
(2)中和反应在生产生活中应用广泛
①含有第3号元素的碱,其化学式为_____,其溶液因为含有_____(填微粒符号)而具有碱性,H2SiO3属于_____(填物质类别),推测这两种物质间发生反应的化学方程式为_____
②氢氧化钾溶液与稀硫酸发生反应的化学方程式为_____,恰好完全反应后的溶液因存在_____(填微粒符号)而具有导电性.
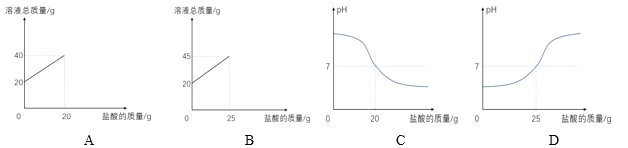
③下表是某酸碱指示剂在不同的pH值范围内显示的颜色
颜色 | 红 | 橙 | 绿 | 蓝 | 紫 |
pH范围 | 1~3 | 4~5 | 6~7 | 8~10 | 11~14 |
某同学用10%的氢氧化钠溶液、7.3%的稀盐酸和上述指示剂做中和反应的实验,当观察到烧杯中颜色恰好由蓝变绿时氢氧化钠溶液反应消耗了20g,则下列图像正确的是_____(填序号)