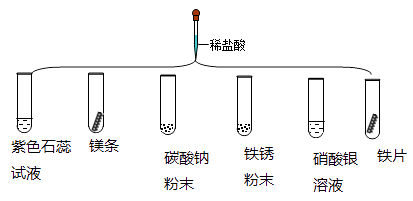
题目内容
【题目】如下图是甲、乙两位同学一起在实验室进行的氢氧化钠与盐酸中和反应的实验。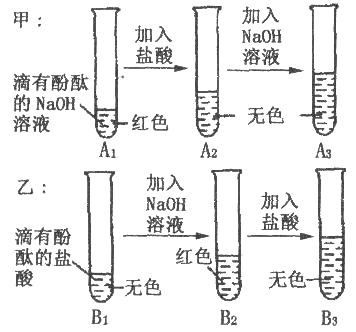
(说明:图中A1、A2、A3、B1、B2、B3均为溶液编号)
根据如图实验,请你与甲、乙同学一起完成下列探究:
探究环节 | 甲同学的探究 | 乙同学的探究 |
提出问题 | A3溶液为什么不变红? | B3溶液中溶质成分是什么?(酚酞不计) |
做出猜想 | 实验过程中,酚酞变质了? | 猜想一:NaCl 猜想二:NaCl HCl |
实验验证 | ①取少量A3 , 溶液于另一试管中,向其中滴加NaOH溶液,溶液变红,说明甲同学的猜想(填“成立”或“不成立”); | 取少量B3溶液加入盛有少量铁粉的试管中,观察到有无色气泡产生,固体逐渐减少,溶液由无色变 , 据此,你认为乙同学的猜想(填“一”或“二”)成立。 |
交流反思 | ①甲、乙同学的实验中,反应均涉及到的化学方程式是; | |
【答案】不成立;<;浅绿色;二;NaOH+HCl=NaCl+H2O;盐酸或氢离子
【解析】加酸进行中和反应,变成中性然后变成酸性,既然原溶液显碱性所以酚酞的颜色开始是红色的,加酸后,红色会逐渐的褪去;
甲:(1)取少量A3溶液于另一试管中,向其中滴加NaOH溶液,溶液变红,说明酚酞溶液没有变质,说明甲同学的猜想不成立;
(2)A3溶液为不变红,可能是A2溶液显酸性,在常温下A2溶液测出的pH应小于7;
乙:取少量B2溶液加入盛有少量铁粉的试管中,观察到有无色气泡产生,固体逐渐减少,溶液由无色变浅绿色,据此,乙同学的猜想二成立;
该反应是氢氧化钠和盐酸发生中和反应生成氯化钠和水,故答案为:NaOH+HCl=NaCl+H2O,
A3溶液为不变红,可能是A2溶液中盐酸较多,加入的NaOH溶液未将其完全中和.
故答案为:(1)不成立;(2)<;(3)浅绿色;(4)二;(5)NaOH+HCl=NaCl+H2O;(6)盐酸或氢离子.
甲:(1)根据加酸进行中和反应,变成中性然后变成酸性,取少量A3溶液于另一试管中,向其中滴加NaOH溶液,溶液变红,说明酚酞溶液没有变质解答;
(2)根据A3溶液为不变红,可能是A2溶液中盐酸较多,加入的NaOH溶液未将其完全中和解答;
乙:根据铁可以和酸反应解答;根据反应物和生成物书写化学反应方程式.

 名校课堂系列答案
名校课堂系列答案