题目内容
(2013?丹徒区模拟)下图所示的实验装置我们常用:
(1)写出B装置中指定仪器名称①
(2)实验室用A装置制取氧气的化学方程式是
(3)实验室用 B装置可以制取二氧化碳,其反应的化学方程式是
(4)用这些装置还可以进行实验探究.例如:碱式碳酸铜是一种绿色粉末,受热易分解产生三种氧化物,其中固态氧化物是
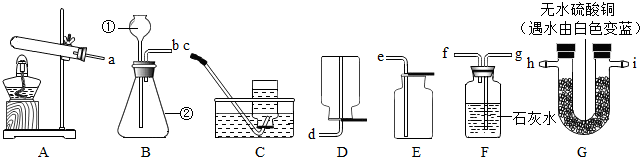
(1)写出B装置中指定仪器名称①
长颈漏斗
长颈漏斗
②锥形瓶
锥形瓶
(2)实验室用A装置制取氧气的化学方程式是
2KClO3
2KCl+3O2↑
| ||
| △ |
2KClO3
2KCl+3O2↑
.若要收集一瓶比较干燥的氧气则应选的收集装置是
| ||
| △ |
E
E
.(填装置编号)(3)实验室用 B装置可以制取二氧化碳,其反应的化学方程式是
CaCO3+2HCl=CaCl2+CO2↑+H2O
CaCO3+2HCl=CaCl2+CO2↑+H2O
;选择的收集装置是:E
E
.(填装置编号)(4)用这些装置还可以进行实验探究.例如:碱式碳酸铜是一种绿色粉末,受热易分解产生三种氧化物,其中固态氧化物是
氧化铜
氧化铜
.选择上述装置中的A与F
F
(填装置编号)组合可以验证另外两种氧化物中常温下为气态的氧化物,该装置中的现象是:澄清的石灰水变浑浊
澄清的石灰水变浑浊
.反应方程式为CO2+Ca(OH)2=CaCO3↓+H2O
CO2+Ca(OH)2=CaCO3↓+H2O
:
分析:(1)据常用仪器回答;
(2)A装置适用于加热固体制取气体,试管口无棉花,说明是用加热氯酸钾的方法制取氧气,据反应原理书写方程式;收集比较干燥的氧气用排空气法;
(3)据实验室制取二氧化碳的反应原理书写方程式,并据二氧化碳的密度和溶解性选择收集装置;
(4)据质量守恒定律可知:碱式碳酸铜受热分解生成氧化铜、水和二氧化碳三种氧化物,常温下氧化铜是固体,二氧化碳是气体,可使澄清的石灰水变浑浊,可用来验证二氧化碳,并据反应原理书写方程式.
(2)A装置适用于加热固体制取气体,试管口无棉花,说明是用加热氯酸钾的方法制取氧气,据反应原理书写方程式;收集比较干燥的氧气用排空气法;
(3)据实验室制取二氧化碳的反应原理书写方程式,并据二氧化碳的密度和溶解性选择收集装置;
(4)据质量守恒定律可知:碱式碳酸铜受热分解生成氧化铜、水和二氧化碳三种氧化物,常温下氧化铜是固体,二氧化碳是气体,可使澄清的石灰水变浑浊,可用来验证二氧化碳,并据反应原理书写方程式.
解答:解:(1)指定仪器分别是长颈漏斗和锥形瓶;
(2)A装置适用于加热固体制取气体,试管口无棉花,说明是用加热氯酸钾的方法制取氧气,方程式是2KClO3
2KCl+3O2↑;氧气的密度比空气大,所以收集比较干燥的氧气用向上排空气法;
(3)实验室制取二氧化碳用大理石和稀盐酸反应,同时生成氯化钙、水和二氧化碳,方程式是:CaCO3+2HCl=CaCl2+CO2↑+H2O;二氧化碳的密度比空气大且能溶于水,故用向上排空气法收集;
(4)据质量守恒定律可知:碱式碳酸铜受热分解生成氧化铜、水和二氧化碳三种氧化物,常温下氧化铜是固体,二氧化碳是气体,可使澄清的石灰水变浑浊,可用来验证二氧化碳,故将产生的气体通入F中,可看到澄清的石灰水变浑浊,方程式是CO2+Ca(OH)2=CaCO3↓+H2O;
故答案为:(1)长颈漏斗;锥形瓶;
(2)2KClO3
2KCl+3O2↑;E;
(3)CaCO3+2HCl=CaCl2+CO2↑+H2O;E;
(4)氧化铜;F;澄清的石灰水变浑浊;CO2+Ca(OH)2=CaCO3↓+H2O.
(2)A装置适用于加热固体制取气体,试管口无棉花,说明是用加热氯酸钾的方法制取氧气,方程式是2KClO3
| ||
| △ |
(3)实验室制取二氧化碳用大理石和稀盐酸反应,同时生成氯化钙、水和二氧化碳,方程式是:CaCO3+2HCl=CaCl2+CO2↑+H2O;二氧化碳的密度比空气大且能溶于水,故用向上排空气法收集;
(4)据质量守恒定律可知:碱式碳酸铜受热分解生成氧化铜、水和二氧化碳三种氧化物,常温下氧化铜是固体,二氧化碳是气体,可使澄清的石灰水变浑浊,可用来验证二氧化碳,故将产生的气体通入F中,可看到澄清的石灰水变浑浊,方程式是CO2+Ca(OH)2=CaCO3↓+H2O;
故答案为:(1)长颈漏斗;锥形瓶;
(2)2KClO3
| ||
| △ |
(3)CaCO3+2HCl=CaCl2+CO2↑+H2O;E;
(4)氧化铜;F;澄清的石灰水变浑浊;CO2+Ca(OH)2=CaCO3↓+H2O.
点评:掌握实验室制取氧气、二氧化碳的反应原理,收集装置主要有排水法、向上排空气法和向下排空气法,收集较干燥的气体用排空气法,收集较纯净的气体用排水法,化学反应前后元素的种类不变,检验二氧化碳用澄清的石灰水.

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
 (2013?丹徒区模拟)下图是a、b、c三种物质的溶解度曲线.由图示判断下列说法中正确的是( )
(2013?丹徒区模拟)下图是a、b、c三种物质的溶解度曲线.由图示判断下列说法中正确的是( ) (2013?丹徒区模拟)(l)青少年正处在生长发育期,应注意营养均衡,合理膳食.有些青少年不爱吃蔬菜、水果,常会引起营养摄入不足.这不仅影响生长发育,还会生病.如得夜盲症主要是由于缺少
(2013?丹徒区模拟)(l)青少年正处在生长发育期,应注意营养均衡,合理膳食.有些青少年不爱吃蔬菜、水果,常会引起营养摄入不足.这不仅影响生长发育,还会生病.如得夜盲症主要是由于缺少