��Ŀ����
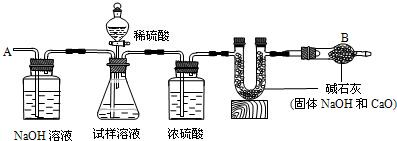
��֪ij���������к��������Ȼ��ƣ�Ϊ�ⶨ�����д��������������������ͼװ�ý���ʵ�飮

��Ҫ�������£���գ�
�ٰ�ͼ��װ�����������
�ڽ�10g����������ƿ�У�����������ˮ�ܽ⣬�õ�������Һ��
�۳���ʢ�м�ʯ�ҵ�U�йܵ�����Ϊ300g��
�ܴӷ�Һ©���е���20%��ϡ���ᣬֱ������ð������Ϊֹ��
�ݴӵ���A����������һ�����Ŀ�����
���ٴγ���ʢ�м�ʯ�ҵ�U�ιܵ�������
���ظ��ݺ͢IJ�����ֱ��U�ιܵ������������䣬�������Ϊ303.3g��
�ش��������⣺
��1��װ��B��ʢ�ŵ��Լ���
��2����û��װ��D����ᵼ�²ⶨ���
��3������ʵ���в�õ��й����ݣ����������д��������������

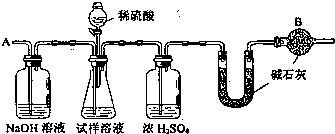
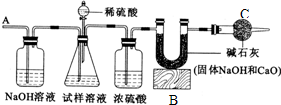
��Ҫ�������£���գ�
�ٰ�ͼ��װ�����������
���װ��������
���װ��������
���ڽ�10g����������ƿ�У�����������ˮ�ܽ⣬�õ�������Һ��
�۳���ʢ�м�ʯ�ҵ�U�йܵ�����Ϊ300g��
�ܴӷ�Һ©���е���20%��ϡ���ᣬֱ������ð������Ϊֹ��
�ݴӵ���A����������һ�����Ŀ�����
���ٴγ���ʢ�м�ʯ�ҵ�U�ιܵ�������
���ظ��ݺ͢IJ�����ֱ��U�ιܵ������������䣬�������Ϊ303.3g��
�ش��������⣺
��1��װ��B��ʢ�ŵ��Լ���
NaOH
NaOH
��ѡ��NaOH������ʯ��ˮ����װ��C��ʢ�ŵ���Ũ����
Ũ����
����2����û��װ��D����ᵼ�²ⶨ���
ƫ��
ƫ��
���ƫ��ƫС������3������ʵ���в�õ��й����ݣ����������д��������������
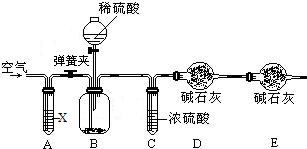
�������ٴ�ʵ�鲽����з�������1����װ��B�dz�ȥ���ڿ����ж�����̼���п��ǣ�װ��C��Ϊ�˳�ȥ�����е�ˮ�������з�������2����û��װ��D��������ˮ�Ͷ�����̼�����U�ιܣ��ٽ�һ���������ɣ���3�������д������������=
��100%��������������֪������Ҫ��������������U��ǰ�����ӵ������Ƿ�Ӧ���ɶ�����̼�����������ݶ�����̼����������������������
| ��������� |
| ���������� |
����⣺��װ�����Ӻú�Ӧ�ȼ��װ�õ������ԣ���װ��©����������������ݻ��������װ�ã�
��1��������Ҫ������̼���������ᷴӦ���ɶ�����̼�������������̼�����������̼���Ƶ��������ٳ�����Ʒ������Ϊ�˽���ƿ�в����Ķ�����̼ȫ������U�ιܣ��ÿ��������ɵĶ�����̼ȫ������U�ι��У�������Ҫ�ѿ����ж�����̼����������Bװ���з�������������Һ����Ϊ�˳�ȥ�����ж�����̼��Ũ���������ˮ�ԣ����������������Ũ����������dz�ȥ������̼�е�ˮ��������ֹˮ��������U��������Cװ���ڷ���Ũ���ᣮ�ʴ�Ϊ����ȥˮ
��2����û��װ��D��������ˮ�Ͷ�����̼�����U�ιܣ�����Ϊ�����ɵĶ�����̼�����Զ�����̼��������������̼��������Ҳƫ�����Խ����ƫ��
��3���贿�������Ϊx
Na2CO3+H2SO4=Na2SO4+CO2��+H2O
106 44
x 303.3g-300g=3.3g
=
x=7.95g
��100%=79.5%
�ʴ�Ϊ���ټ��װ�������ԣ���1��NaOH��Ũ�����2��ƫ��3��79.5%��
��1��������Ҫ������̼���������ᷴӦ���ɶ�����̼�������������̼�����������̼���Ƶ��������ٳ�����Ʒ������Ϊ�˽���ƿ�в����Ķ�����̼ȫ������U�ιܣ��ÿ��������ɵĶ�����̼ȫ������U�ι��У�������Ҫ�ѿ����ж�����̼����������Bװ���з�������������Һ����Ϊ�˳�ȥ�����ж�����̼��Ũ���������ˮ�ԣ����������������Ũ����������dz�ȥ������̼�е�ˮ��������ֹˮ��������U��������Cװ���ڷ���Ũ���ᣮ�ʴ�Ϊ����ȥˮ
��2����û��װ��D��������ˮ�Ͷ�����̼�����U�ιܣ�����Ϊ�����ɵĶ�����̼�����Զ�����̼��������������̼��������Ҳƫ�����Խ����ƫ��
��3���贿�������Ϊx
Na2CO3+H2SO4=Na2SO4+CO2��+H2O
106 44
x 303.3g-300g=3.3g
| 106 |
| 44 |
| X |
| 3.3g |
| 7.95g |
| 10g |
�ʴ�Ϊ���ټ��װ�������ԣ���1��NaOH��Ũ�����2��ƫ��3��79.5%��
��������ʵ���װ������˳��dz����ܣ���ǰ�������������Һ��Ϊ�˷�ֹ�����еĶ�����̼����װ�ã������ļ�ʯ��Ҳ��Ϊ�˷�ֹ�����еĶ�����̼����װ�ã�

��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ