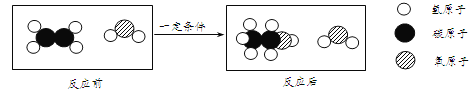
题目内容
【题目】A、B、C三种物质的溶解度曲线如图所示,下列叙述正确的是( )
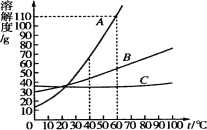
A.60℃的A、B、C三种物质的溶液中A物质的溶液中所含溶质的质量最多
B.60℃时A、B、C三种物质的等质量饱和溶液,降温至40℃时析出晶体最多的是A
C.40℃时A物质60g放入50g水溶解后升温至60℃时,溶质的质量分数增大,由饱和溶液变为不饱和溶液
D.物质C中混有少量A时,可以用降温结晶的方法提纯物质C
【答案】B
【解析】
![]() 试题分析:A、60℃时,A、B、C三种物质的溶解度大小关系是A>B>C>,所以A、B、C三种物质的饱和溶液中A物质的溶液中所含溶质的质量最多,而这里没有指明是饱和溶液,错误,B、通过溶解度曲线图,可看出物质A的溶解度随温度的升高而变化最大,所以60℃时A、B、C三种物质的等质量饱和溶液,降温至40℃时析出晶体最多的是A,正确, C、60℃时,A的溶解度小于110g,表示在100g溶剂中,达到饱和状态溶解A的质量最多是110g,所以在50 g水中最多能溶解55g,故40℃时A物质60g放入50g水溶解后升温至60℃时,固体不能全部溶解,溶液仍然是饱和,错误,D、由于C物质的溶解度随温度的升高而变化不大,所以物质C中混有少量A时,可以用蒸发结晶的方法提纯C,错误,故选B
试题分析:A、60℃时,A、B、C三种物质的溶解度大小关系是A>B>C>,所以A、B、C三种物质的饱和溶液中A物质的溶液中所含溶质的质量最多,而这里没有指明是饱和溶液,错误,B、通过溶解度曲线图,可看出物质A的溶解度随温度的升高而变化最大,所以60℃时A、B、C三种物质的等质量饱和溶液,降温至40℃时析出晶体最多的是A,正确, C、60℃时,A的溶解度小于110g,表示在100g溶剂中,达到饱和状态溶解A的质量最多是110g,所以在50 g水中最多能溶解55g,故40℃时A物质60g放入50g水溶解后升温至60℃时,固体不能全部溶解,溶液仍然是饱和,错误,D、由于C物质的溶解度随温度的升高而变化不大,所以物质C中混有少量A时,可以用蒸发结晶的方法提纯C,错误,故选B

 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】(7分)某同学做了如下实验:

实验数据及部分实验现象如下表:
第一次 | 第二次 | |
加氧化铜的质量(g) | m | m |
加稀硫酸的质量(g) | 50 | 100 |
加氢氧化钡溶液的质量(g) | 100 | 100 |
B中主要现象 | 淡蓝色沉淀 | ? |
若第一次试验每一步均恰好完全反应且所用氢氧化钡溶液的溶质的质量分数为8.55%,请回答下列问题:
1、写出第一次试验有溶液颜色改变的化学反应方程式 ;
2、第二次实验B中的主要现象是 ;
3、试验中加入氧化铜m的数值为 ;
4、求解第二次反应中生成固体质量(X)的比例式 ;
5、若将第二次反应后的滤液蒸发32.35克水,则所得不饱和溶液中溶质的质量分数为 ;
6、若用98%的浓硫酸配制试验中所需硫酸,则需要加水的质量为 。