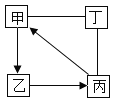
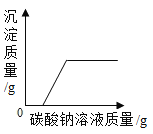
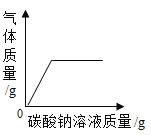
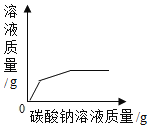
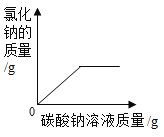
题目内容
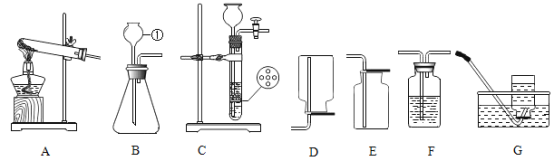
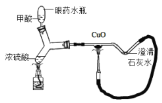
【题目】根据下图的实验常用仪器回答有关问题。

(1)若用KMnO4加热制取氧气,应选用上述仪器中的_____(填序号);其化学方程式为_____;
(2)当用铁夹固定好试管后,要使试管口略低于试管底部。应调节螺旋____(填“K1”、“K2”或“K3”);要调节试管与酒精灯相对高度,应调节螺旋______
(3)若用废铁片与稀盐酸反应制取氢气.并装配一个使反应随时发生和停止的装置.应选上述仪器中的_______。
(4)如图为某同学制作的微型实验装置(夹持仪器略)。甲酸与热的浓硫酸反应的方程式为:
①则X是________(填化学式)
②固体的颜色变化为________;其化学反应方程式为________。
③此实验装置的主要优点是环保,其理由是_______。
【答案】A、B、E 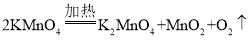 K2 K1 C、D、I
K2 K1 C、D、I ![]() 黑色变成红色
黑色变成红色 ![]() 未和氧化铜反应的一氧化碳被点燃再利用,生成二氧化碳,不污染环境,并且节约能源
未和氧化铜反应的一氧化碳被点燃再利用,生成二氧化碳,不污染环境,并且节约能源
【解析】
(1)若用![]() 加热制取氧气,发生装置应选用上述仪器中的铁架台A、酒精灯B和试管E,加热高锰酸钾反应生成锰酸钾、二氧化锰和氧气,其化学方程式为:
加热制取氧气,发生装置应选用上述仪器中的铁架台A、酒精灯B和试管E,加热高锰酸钾反应生成锰酸钾、二氧化锰和氧气,其化学方程式为: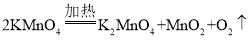 ;
;
(2)当用铁夹固定好试管后,要使试管口略低于试管底部,应调节螺旋K2;要调节试管与酒精灯相对高度,应调节螺旋K1。
(3)若用废铁片与稀盐酸反应制取氢气,并装配一个控制反应发生与停止的发生装置,应选上述仪器中的C、D、I;
(4)①由 可知,反应前氢原子是2个,反应后应该是2个,包含在X中,反应前的氧原子是2个,反应后应该是2个,其中1个包含在X中,反应前后碳原子都是1个,则X是
可知,反应前氢原子是2个,反应后应该是2个,包含在X中,反应前的氧原子是2个,反应后应该是2个,其中1个包含在X中,反应前后碳原子都是1个,则X是![]() ;
;
②氧化铜和一氧化碳在加热条件下反应生成铜和二氧化碳,颜色变化为黑色变成红色,其化学反应的方程式为:![]() ;
;
③此实验装置的主要优点是环保,其理由是:未和氧化铜反应的一氧化碳被点燃再利用,生成二氧化碳,不污染环境,并且节约能源。

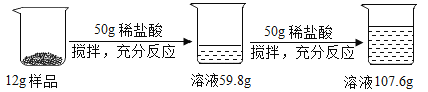
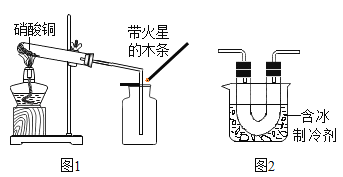
【题目】加热硝酸铜[Cu(NO3)2]可以制取氧化铜。用图1装置加热蓝色硝酸铜固体。发现固体由蓝色逐渐变黑,同时产生红棕色有刺激性气味的气体,带火星的木条复燃。
[提出问题]硝酸铜加热生成什么气体?
[查阅资料]①含氮化合物中,只有二氧化氮是红棕色、有刺激性气味的气体
②二氧化氮密度大于空气,具有助燃性,…………
[猜想假设]猜想一:生成气体是(填写化学式)________________。
猜想二:生成气体是二氧化氮和氧气
[进行实验]在图1的试管和集气瓶之间连接图2所示装置,重新加热硝酸铜;
[实验现象]________________。
[实验结论]猜想二正确:写出有关化学反应文字表达式:________________。
[反思与评价](1)根据图2装置补充参阅资料②中“………..”NO2的性质是________________。
(2)化学反应前后原子个数不变,经计算生成二氧化氮与氧气的分子个数比为4:1;已知相同状况下,气体的体积比等于其分子个数比。据此,同学们认为,即使没有资料②,依据实验结论和“加热硝酸铜产生的气体能使带火星的木条复燃”的实验现象,也能推出二氧化氮可能具有助燃性。理由是________________。
[实验延伸]取制取的氧化铜0.2g,加入5mL5%的双氧水中,发现立即产生大量气泡,带火星木条复燃;氧化铜是否为反应催化剂?请补充实验证明。
实验操作 | 实验现象 | 实验结论 |
_______________ | __________________ | 氧化铜在反应前后质量化学性质不变,是双氧水制取氧气的催化剂。 |
________________ | _________________ |