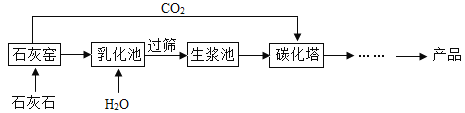
题目内容
【题目】在一烧杯中盛有CaCl2和HCl的混合溶液100g,向其中逐渐滴加溶质质量分数为10%Na2CO3溶液,混合溶液的质量与所滴入的Na2CO3溶液的质量关系图象如图所示。
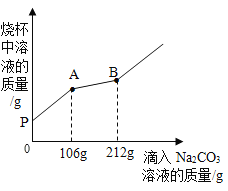
(1)在实验过程中,其中出现冒气泡的是______(填“PA”或“AB”)段。
(2)逐渐滴入碳酸钠溶液的过程中,杯中溶液的pH如何变化____?
(3)原溶液中HCl的质量是多少克____?
(4)当滴入Na2CO3溶液至图中B点时,通过计算求烧杯中(不饱和溶液)溶质的质量分数为多少____?(计算结果精确到0.1%)
【答案】PA pH逐渐变大 7.3g 7.9%
【解析】
(1)在实验过程中,由于混合溶液中含有盐酸和氯化钙,所以加入碳酸钠溶液时,先生成气体后生成沉淀,所以出现冒气泡的是 PA段,而AB段是生成沉淀的;
(2)由于混合溶液中含有盐酸和氯化钙,盐酸先被反应掉,所以逐渐滴入碳酸钠溶液的过程中,杯中溶液的pH有小于7,慢慢变大,后来等于7,最有由于碳酸钠过量,而碳酸钠溶液显碱性,所以pH大于7;
(3)设原溶液中HCl的质量是x,生成的氯化钠的质量为y,生成的二氧化碳的质量为z,
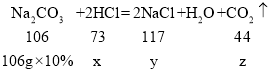
![]()
x=7.3g,y=11.7g,z=4.4g,
(4)设碳酸钠与氯化钙反应生成的碳酸钙的质量为a,生成的氯化钠的质量为b,
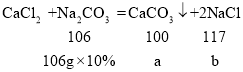
![]()
a=10g,b=11.7g,
当滴入Na2CO3溶液至图中B点时,烧杯中(不饱和溶液)溶质的质量分数=![]() ×100%≈7.9%;
×100%≈7.9%;
答:(1)在实验过程中,其中出现冒气泡的是 PA段;
(2)逐渐滴入碳酸钠溶液的过程中,杯中溶液的pH逐渐变大;
(3)原溶液中HCl的质量是7.3g;
(4)当滴入Na2CO3溶液至图中B点时,烧杯中(不饱和溶液)溶质的质量分数为7.9%。

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案【题目】碳酸氢铵(NH4HCO3),俗称“碳铵”,是农村常用的氮肥。NH4HCO3可溶于水:受热容易分解,生成三种物质,经检测,这三种物质性质如下:
生成物 | 相关性质 |
生成物(一) | 无色无味的液体,常用作溶剂 |
生成物(二) | 能使澄清石灰水变浑浊的气体。 |
生成物(三) | 有刺激性气味的气体,水溶液呈碱性。 |
(1)请写出碳酸氢铵受热分解的化学方程式:_____。
(2)请预测碳酸氢铵的化学性质,说明预测的依据,并设计实验验证。
限选试剂是:碳酸氢铵粉末、熟石灰、食盐、稀硫酸、紫色石蕊溶液、炭粉、镁条、氧化铜。
预测 | 预测的依据 | 验证预测的实验操作与预期现象 |
①能够与酸类反应 | 碳酸氢铵组成里有碳酸氢根离子 | 取少量碳酸氢铵粉末于试管中,加入足量的_____,如果观察到_____,则预测成立。 |
②能够与_____(填物质类别)反应 | _____ | 取少量碳酸氢铵粉末_____。如果_____,则预测成立。 |
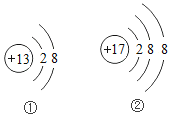
【题目】“下图”是部分元素的原子结构示意图和元素周期表的一部分。请回答:
| ||||||
| ||||||
|
| |||||
(1)图①、②中属于阴离子的是_____________(填序号);
(2)元素周期表中13号元素的元素符号为______________;
(3)由元素周期表中原子序数为1、8、13的元素组成物质的化学式为_________________。