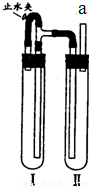
题目内容
 22、已知Fe(OH)2在潮湿的空气中氧化成Fe(OH)3
22、已知Fe(OH)2在潮湿的空气中氧化成Fe(OH)3(1)该反应的化学方程式为
4Fe(OH)2+O2+2H2O=4Fe(OH)3
.(2)现用下面两种方法制白色的Fe(OH)2沉淀.
方法一:用FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备.
①除去蒸馏水中溶解的O2常采用的方法是
煮沸
:②生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,伸到FeSO4溶液液面
下
(填“上”或“下”),再挤出NaOH溶液,这样操作的理由是避免Fe(OH)2与空气中的氧气接触而被氧化.方法二:在如图装置中,用NaOH溶液,铁屑,稀硫酸制备.
(3)制备Fe(OH)2的原理是
Fe+H2SO4=FeSO4+H2↑
、FeSO4+2NaOH=Fe(OH)2↓+Na2SO4
(用化学方程式表示).(4)在试管 I里加入的试剂是
铁屑和稀H2SO4
.(5)为了使生成的Fe(OH)2沉淀能较长时间保持白色,在试管 I和试管 II中加入试剂,塞紧塞子后,打开止水夹,当观察到试管 I里出现
大量气泡产生
现象时,应在a处进行的实验是验纯
(填实验名称).分析:运用酸碱盐的化学性质和金属的活动顺序,能较快的正确的解答该题.
解答:解:(1)由Fe(OH)2在潮湿的空气中氧化成Fe(OH)3,需要有氧化剂氧气的参与,该反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(2)由于氧气在水中的溶解随温度的升高而减小,煮沸可以使溶解在水中的氧气逸出;深入到液面下,可以避免被空气中的氧气氧化;
(3)制备Fe(OH)2运用酸碱盐的化学性质和金属的活动顺序可知Fe+H2SO4=FeSO4+H2↑、FeSO4+2NaOH=Fe(OH)2↓+Na2SO4
(4)在试管I里加入的试剂是铁屑和稀H2SO4 (5)铁和稀硫酸反应生成氢气,氢气为可燃性气体,使用之前必须检验它的纯度.
故答案为:(1)4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(2)①煮沸:②下 (填“上”或“下”),
(3)Fe+H2SO4=FeSO4+H2↑、FeSO4+2NaOH=Fe(OH)2↓+Na2SO4
(4)铁屑和稀H2SO4
(5)大量气泡产生、验纯
(2)由于氧气在水中的溶解随温度的升高而减小,煮沸可以使溶解在水中的氧气逸出;深入到液面下,可以避免被空气中的氧气氧化;
(3)制备Fe(OH)2运用酸碱盐的化学性质和金属的活动顺序可知Fe+H2SO4=FeSO4+H2↑、FeSO4+2NaOH=Fe(OH)2↓+Na2SO4
(4)在试管I里加入的试剂是铁屑和稀H2SO4 (5)铁和稀硫酸反应生成氢气,氢气为可燃性气体,使用之前必须检验它的纯度.
故答案为:(1)4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(2)①煮沸:②下 (填“上”或“下”),
(3)Fe+H2SO4=FeSO4+H2↑、FeSO4+2NaOH=Fe(OH)2↓+Na2SO4
(4)铁屑和稀H2SO4
(5)大量气泡产生、验纯
点评:只有熟练掌握酸碱盐的化学性质才能快速准确的做出这类题的正确答案,本题综合性强,有利于培养学生分析实验解决实验的能力

练习册系列答案
相关题目
 (2008?杭州)已知Fe(OH)2是白色絮状沉淀,并极易被空气中的氧气氧化成Fe(OH)3红褐色沉淀.如图为Fe(OH)2制备实验的改进装置,使用该装置能在较长时间内观察到生成的Fe(OH)2白色絮状沉淀.
(2008?杭州)已知Fe(OH)2是白色絮状沉淀,并极易被空气中的氧气氧化成Fe(OH)3红褐色沉淀.如图为Fe(OH)2制备实验的改进装置,使用该装置能在较长时间内观察到生成的Fe(OH)2白色絮状沉淀. 的改进装置,使用该装置能在较长时间内观察到生成的Fe(OH)2白色絮状沉淀.
的改进装置,使用该装置能在较长时间内观察到生成的Fe(OH)2白色絮状沉淀.