题目内容
【题目】写出下列反应的化学方程式式
(1)一种金属在空气中燃烧,发出耀眼的白光,并生成白色固体:___________________________________
(2)一种银白色金属丝在氧气中剧烈燃烧,火星四射: ____________________________________
【答案】 略 略
【解析】 (1)镁在空气中燃烧,发出耀眼的白光,并生成白色固体氧化镁,故反应的化学方程式:2Mg+O2点燃2MgO ;(2)铁丝在氧气中剧烈燃烧,火星四射生成四氧化三铁,故反应的化学方程式:3Fe+2O2点燃Fe3O4。

 阅读快车系列答案
阅读快车系列答案【题目】小明的学习小组选择“过氧化氢生成氧气的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:
【假设】过氧化氢生成氧气的快慢与催化剂种类有关。
【实验方案】常温下,在两瓶体积相同、浓度相同的过氧化氢溶液中分别加入相同质量和状态的二氧化锰和红砖粉,测量各生成一瓶(相同体积)氧气所需要的时间。
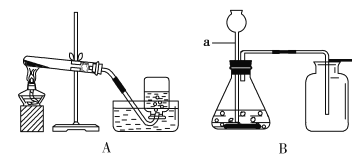
【进行实验】图示是他们进行实验的装置图,气体发生装置中A仪器的名称是____,此实验中B处宜采用C装置收集,导管口a应连接___口(选填“b”或“c”) ,写出A装置中反应文字表达式______________


【实验记录】
实验编号 | 1 | 2 |
反应物 | 5%过氧化氢 | 5%过氧化氢 |
催化剂 | 1 g红砖粉 | 1 g二氧化锰 |
时间 | 155 s | 38 s |
【结论】该探究过程得出的结论____________________________。
【反思】(1)过氧化氢在常温下反应很缓慢,加入二氧化锰或红砖粉后反应明显加快。若要证明二氧化锰和红砖粉是否是该反应的催化剂,还需要增加实验来验证它们在化学反应前后_______和______是否变化。
(2)除测量各生成一瓶(相同体积)氧气所需要的时间外,你还可以设计通过测量______________得出相同结论。