题目内容
【题目】小明的学习小组选择“过氧化氢生成氧气的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:
【假设】过氧化氢生成氧气的快慢与催化剂种类有关。
【实验方案】常温下,在两瓶体积相同、浓度相同的过氧化氢溶液中分别加入相同质量和状态的二氧化锰和红砖粉,测量各生成一瓶(相同体积)氧气所需要的时间。
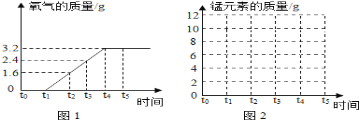
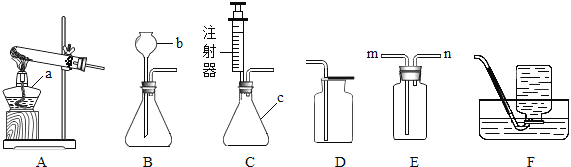
【进行实验】图示是他们进行实验的装置图,气体发生装置中A仪器的名称是____,此实验中B处宜采用C装置收集,导管口a应连接___口(选填“b”或“c”) ,写出A装置中反应文字表达式______________


【实验记录】
实验编号 | 1 | 2 |
反应物 | 5%过氧化氢 | 5%过氧化氢 |
催化剂 | 1 g红砖粉 | 1 g二氧化锰 |
时间 | 155 s | 38 s |
【结论】该探究过程得出的结论____________________________。
【反思】(1)过氧化氢在常温下反应很缓慢,加入二氧化锰或红砖粉后反应明显加快。若要证明二氧化锰和红砖粉是否是该反应的催化剂,还需要增加实验来验证它们在化学反应前后_______和______是否变化。
(2)除测量各生成一瓶(相同体积)氧气所需要的时间外,你还可以设计通过测量______________得出相同结论。
【答案】 锥形瓶 c 过氧化氢 → 水+氧气 过氧化氢生成氧气的快慢与催化剂的种类有关 质量 化学性质 相同时间产生氧气的体积
【解析】【进行实验】气体发生装置中A仪器名称是锥形瓶;此实验中B处宜采用的气体收集方法是排水法收集,根据压强原理应连接c端;过氧化氢分解的文字表达式为:过氧化氢 →水+氧气;【结论】根据表格中的数据可以知道加入了二氧化锰和红砖粉后过氧化氢的分解速率加快,说明催化剂的种类对反应速率有影响;【反思】(1) 根据催化剂的概念可知,催化剂能改变化学反应的速率,而本身的质量和化学性质在反应前后不改变;(2) 在温度、相同质量的相同催化剂的条件下,采用等质量但不同的浓度的过氧化氢溶液来进行实验,然后测量相同时间产生氧气的体积,从而得出结论。

【题目】合成氨是人类科学技术上的一项重大突破,对社会发展与科技进步做出了巨大贡献。合成氨工艺的主要流程如下:
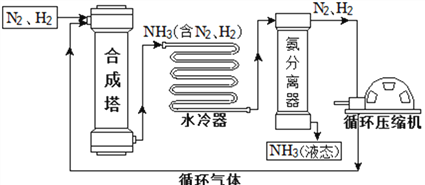
(1)合成塔中的反应必须在高温、高压、催化剂条件下进行,该反应的符号表达式是:__________________________________________________。
(2)生产过程中可重复使用的物质是_______________(填化学式)。
(3)根据表中的数据回答问题。
物质 | H2 | N2 | O2 | NH3 |
沸点/℃(1.01×105 Pa) | –252 | –195.8 | –183 | –33.35 |
在1.01×105 Pa时,要将产物NH3与N2、H2分离开来,最适宜的温度应该控制在______℃。
(4)下图是合成塔中发生反应的微观粒子示意图:
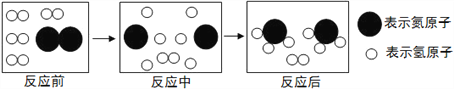
由图可知两种反应物N2与H2的分子个数比为____;该反应中的最小粒子是_________(填写化学符号)。