题目内容
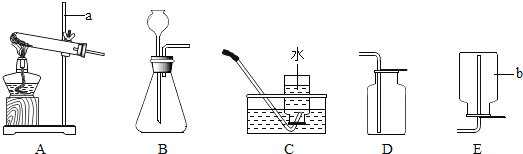
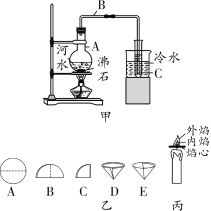
【题目】用如图装置在相应条件下完成下列实验

(1)模拟工业炼铁:A处通CO, B盛Fe2O3粉末,B处下方放酒精喷灯,D处放酒精灯。实验:在A处通入CO时,应立即点燃___________处(填“B”或“D”)酒精(喷)灯,反应过程中,C处反应的化学方程式为_________________
(2)探究金属氧化物的组成:A处通CO,B盛金属氧化物,B处下方放酒精喷灯、D处放酒精灯,B中所盛粉末:CuO或Fe3O4或两者混合物。
实验:同(1)操作、完全反应后,B中可观察到_________。
实验结论(定性):试管B中的黑色粉末为CuO和Fe3O4两者混合物。
定量经测定反应前B重180克,完全反应后B重170.4克,将反应后B中固体全部加入到足量的稀硫酸中,完全反应后经过滤、洗涤、干燥,测得剩余固体12.8克。
实验结论(定量):m(CuO):m(Fe3O4)=_____________(写最简整数比)。
【答案】D Ca(OH)2+CO2=CaCO3↓+H2O 既有红色固体生成,又有黑色固体生成 20:29
【解析】
(1)在A处通入CO时,应立即点燃D处酒精灯,点燃一氧化碳,防止一氧化碳污染环境,C处澄清石灰水变浑浊,氢氧化钙和二氧化碳生成碳酸钙和水,化学方程式为Ca(OH)2+CO2=CaCO3↓+H2O,故填:D;Ca(OH)2+CO2=CaCO3↓+H2O。
(2)由实验结论试管B中的黑色粉末为CuO和Fe3O4两者混合物,氧化铜和一氧化碳反应会生成红色铜和二氧化碳,四氧化三铁和一氧化碳反应,生成黑色铁粉和二氧化碳,故现象为既有红色固体生成,又有黑色固体生成,完全反应后经过滤、洗涤、干燥,测得剩余固体12.8克,铜和稀硫酸不反应,12.8g固体是铜,设氧化铜质量为x,氧化铜和稀硫酸反应固体减少质量为y,则:
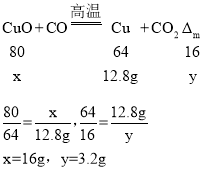
则四氧化三铁和稀硫酸反应固体减少质量为:180g-170.4g-3.2g=6.4g,设四氧化三铁质量为z。

故m(CuO):m(Fe3O4)=16g:23.2g=20:29,故填:既有红色固体生成,又有黑色固体生成;20:29。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】在一密闭容器内加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,反应前后各物质的质量变化见下表。下列说法中正确的是(_______)
物质 | 甲 | 乙 | 丙 | 丁 |
反应前质量/g | 8 | 32 | 5 | 4 |
反应后质量/g | 16 | 4 | x | 24 |
A 、X=5
B、丙一定为该反应的催化剂
C、反应生成物为乙
D、反应中甲、乙物质的最简质量比为________