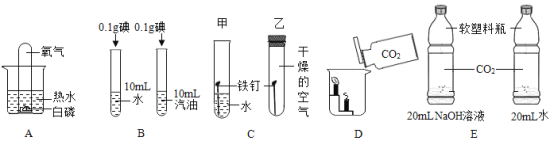
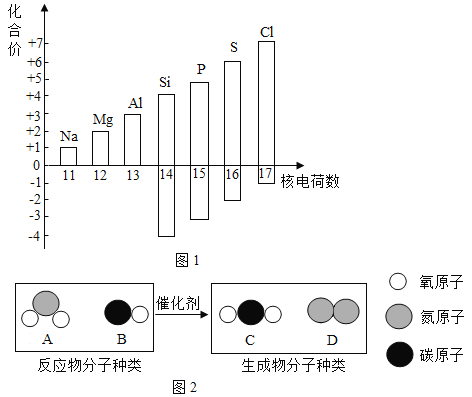
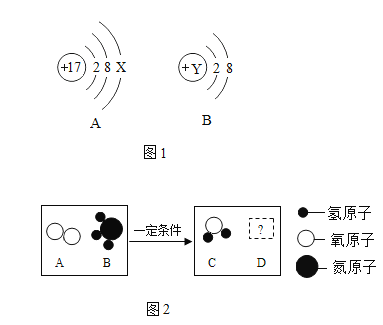
题目内容
【题目】A、B、C、D、E是初中化学中常见的五种物质,A为黑色固体, A、B、C、E均含同一种金属元素,C为单质,D只含有两种元素,它们的转化关系如图所示(“→”表示一种物质 可以生成另一种物质,部分物质已略去)。请回答下列问题:
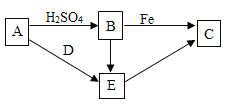
(1)C的化学式为_______。
(2)D的一种用途为_________。
(3)B→E的化学方程式为_____,该反应的基本反应类型为______。
【答案】Cu 金属除锈(合理即可) ![]() 复分解反应
复分解反应
【解析】
A为黑色固体,且能与硫酸反应同时含有一种金属元素,则A是氧化铜,氧化铜能与硫酸反应产生硫酸铜,则B是硫酸铜,硫酸铜和铁反应生成铜和硫酸亚铁,C是单质铜, D只含有两种元素,且能与氧化铜反应,则D是盐酸,氧化铜与盐酸反应产生氯化铜和水,E是氯化铜。
(1)C是铜单质,化学式为Cu。
(2)D是盐酸,盐酸能与铁锈发生反应,其一种用途为:除铁锈;
(3)B→E:硫酸铜与氯化钡反应产生硫酸钡沉淀和氯化铜的化学方程式为![]() ,该反应符合“两交换,价不变”,属于复分解反应。
,该反应符合“两交换,价不变”,属于复分解反应。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
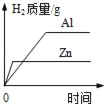
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】同学们在实验室发现了三种金属——铝、铁、铜,其中一块铜片生锈了,表面附有部分铜绿[铜绿的主要成分是Cu2(OH)2CO3],他们的实验探究过程如下:
(1)铜绿是铜与空气中的氧气、水和______(填化学式)共同作用的结果。
(2)为探究铝、铁、铜的活动性顺序,某同学设计了一组实验:①铝片浸入稀硫酸中;②铜片浸入稀硫酸中;③铝片浸入氯化亚铁溶液中,这组实验还不能完全证明三种金属的活动性顺序。请你补充一个实验来达到实验目的(写出化学方程式)______。
(3)他们用加热的方法除去铜绿,加热时却发现铜片表面全部变黑。经查阅资料知道:①铜绿受热分解会生成黑色的氧化铜 ②酒精在不完全燃烧时会生成炭黑 ③炭黑与稀硫酸不反应。
a、他们提出猜想:该黑色物质可能是氧化铜,也可能是氧化铜和_________的混合物。
b、设计了下述实验方案,用于检验黑色物质。
实验步骤 | 实验现象 | 结论 |
剪下一片变黑的铜片,放入盛有足量稀硫酸的试管中,微热 | 铜片表面黑色固体全部消失,露出红色的铜,溶液变______色。 | 此黑色固体是____(填化学式) |