题目内容
【题目】分别用以下三组所提供的物质比较锌和铜的金属活动性:①Zn、Cu、稀硫酸;②Zn、Cu、MgSO4溶液;③Cu、 ZnSO4溶液。能够直接达到目的的是
A.①③ B.②③ C.仅有① D.①②③
【答案】A
【解析】
试题分析:①Zn与硫酸反应能放出氢气,说明锌排在了氢的前面,Cu与硫酸不反应说明铜排在了氢的后面,所以锌比铜活泼,所以能比较;②Zn和Cu都不能与MgSO4溶液反应,只能说明Zn和Cu都排在了镁的后面,但比较不出锌和铜的活泼性,所以不能比较;③Cu与ZnSO4溶液不反应,说明铜排在了锌的后面,所以能比较.故选A.

【题目】酸溶液和碱溶液混合会发生怎样的变化呢?某班级同学开展如图1所示相关的实验.下面是两个小组的实验
记录与分析.请根据要求回答问题:
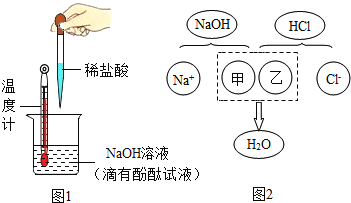
(1)甲组同学往一定体积10%的氢氧化钠溶液样品中滴加10%的盐酸(室温下),反应中溶液温度的变化记录如下:
加入盐酸的体积(V)/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
溶液温度上升 (△t)/℃ | 5.6 | 9.8 | 12.1 | 16.3 | 18.5 | 17.1 | 15.2 | 14.6 | 13.5 | 12.6 |
根据上表数据分析:
①当加入盐酸体积为__mL时,表明NaOH与HCl恰好完全反应.此判断的依据是__.
②当加入6mL盐酸时,烧杯中溶液仍然呈红色,该溶液中含有的溶质有酚酞和__.
③教材指出:酸与碱中和反应的结果是酸和碱各自的特性都消失.图2描述的是氢氧化钠与盐酸反应的微观实质,请从微观的角度分析,甲、乙处应填入的化学符号依次是__、__.
(2)请你参与完成乙组同学的实验记录与分析.
实验操作 | 实验现象 | 分析与结论 |
步骤一:往装有氢氧化钠溶液样品的试管中先滴加2~3滴的 酚酞试液,再逐滴加入稀盐酸 | 现象一:有气泡产生 现象二:__ | 1.该氢氧化钠溶液样品已变质 2.溶液碱性消失 |
现象一:有气泡产生 现象二:溶液开始不变色,后逐渐变成红色 | 1.产生“气泡”这一现象对应的化学方程式为__ 2.所取的步骤一反应后的溶液pH__7(填“<”、“=”或“>”) |