题目内容
锰为不锈钢主要的添加元素.锰的氧化物是不锈钢的保护膜,可以提高不锈钢的耐腐蚀性.(1)铁生锈的主要原因是铁与氧气和 直接接触.
(2)不锈钢是 (填“纯净物”或“混合物”).
(3)相同温度下,取大小相同、表面光亮的锰、镁、铁三种金属片,分别投入足量的、质量分数相同的稀盐酸中(反应中锰的化合价为+2价),现象如表:
| 金属种类 | 锰(Mn) | 镁 | 铁 |
| 与盐酸反应 | 略慢 | 快 | 很慢 |
A.Mn+H2SO4=MnSO4+H2↑ B.Mg+MnSO4=MgSO4+Mn
C.Fe+MnSO4=FeSO4+Mn D.Mn+CuSO4=MnSO4+Cu
(4)金属与酸的反应存在某种规律,请你分析下表中的数据,找到对应关系.
| 等质量的金属(a克)与足量盐酸反应 | 镁 | 铁 | 锰 |
| 金属的相对原子质量 | 24 | 56 | 55 |
| 产生氢气的质量(g) |  |  | 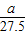 |
| 找到的规律 | |||
【答案】分析:(1)根据铁生锈的条件:铁生锈需要和哪些物质反应来考虑本题;
(2)根据不锈钢的成分再结合混合物的定义:由不同物质组成的物质考虑;
(3)根据金属与酸反应的快慢排出顺序:反应速度越快的金属活动性越强,再根据排在前面的金属能把排在后面的金属从它的盐溶液里置换出来;
(4)根据表中数据:金属相对原子质量与生成氢气的关系进行分析.
解答:解:(1)铁生锈的条件是铁与氧气和水共同接触;
(2)不锈钢是铁的合金,既含有铁又含有碳等杂质,所以为混合物;
(3)金属与酸反应的速度越快说明越活泼,所以由图表可知镁最活泼,锰次之,铁最不活泼,但能与酸反应说明排在了氢的前面,镁、铁、锰都能与酸反应,所以A正确,由于镁比锰活泼所以B能反应,由于锰比铁活泼,所以C不能反应;由于铜排在了氢的后面,锰排在了氢的前面,所以锰能与硫酸铜反应;
(4)根据表中数据可分析出相同质量的同价态的不同金属,与足量的酸反应,相对原子质量越大,生成氢气质量越小;相对原子质量越小,生成氢气质量越大.
故答案:
(1)水;
(2)混合物;
(3)C;
(4)相同质量的同价态的不同金属,与足量的酸反应,相对原子质量越大,生成氢气质量越小;反之亦然.
点评:解答本题的关键是知道铁生锈的条件和不锈钢的组成,通过金属与酸反应判断金属活动性的方法,知道金属与盐反应的条件排在前面的金属能把排在后面的金属从它的盐溶液里置换出来.
(2)根据不锈钢的成分再结合混合物的定义:由不同物质组成的物质考虑;
(3)根据金属与酸反应的快慢排出顺序:反应速度越快的金属活动性越强,再根据排在前面的金属能把排在后面的金属从它的盐溶液里置换出来;
(4)根据表中数据:金属相对原子质量与生成氢气的关系进行分析.
解答:解:(1)铁生锈的条件是铁与氧气和水共同接触;
(2)不锈钢是铁的合金,既含有铁又含有碳等杂质,所以为混合物;
(3)金属与酸反应的速度越快说明越活泼,所以由图表可知镁最活泼,锰次之,铁最不活泼,但能与酸反应说明排在了氢的前面,镁、铁、锰都能与酸反应,所以A正确,由于镁比锰活泼所以B能反应,由于锰比铁活泼,所以C不能反应;由于铜排在了氢的后面,锰排在了氢的前面,所以锰能与硫酸铜反应;
(4)根据表中数据可分析出相同质量的同价态的不同金属,与足量的酸反应,相对原子质量越大,生成氢气质量越小;相对原子质量越小,生成氢气质量越大.
故答案:
(1)水;
(2)混合物;
(3)C;
(4)相同质量的同价态的不同金属,与足量的酸反应,相对原子质量越大,生成氢气质量越小;反之亦然.
点评:解答本题的关键是知道铁生锈的条件和不锈钢的组成,通过金属与酸反应判断金属活动性的方法,知道金属与盐反应的条件排在前面的金属能把排在后面的金属从它的盐溶液里置换出来.

练习册系列答案
相关题目
(2010?宣武区二模)金属与人类生活、生产密不可分.
(1)某小组设计如图装置来观察铁制品锈蚀的原因.
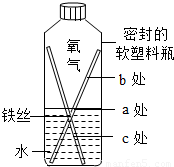
①铁生锈的条件是;
写出一条防止课桌腿生锈的方法.
②一段时间后,右图中可观察到处锈蚀最严重和的现象.
(2)锰为不锈钢主要的添加元素.锰的氧化物是不锈钢的保护膜,可以提高不锈钢的耐腐蚀性.
1相同温度下,取大小相同、表面光亮的锰、镁、铜三种金属片,分别投入足量的、质量分数相同的稀盐酸中(反应中锰的化合价为+2价),现象如表:
上述三种金属的活动性由弱到强的顺序是;写出锰与稀盐酸反应的化学方程式.
2金属与酸的反应存在某种规律,请你分析下表中的数据,找到对应关系.
(1)某小组设计如图装置来观察铁制品锈蚀的原因.

①铁生锈的条件是;
写出一条防止课桌腿生锈的方法.
②一段时间后,右图中可观察到处锈蚀最严重和的现象.
(2)锰为不锈钢主要的添加元素.锰的氧化物是不锈钢的保护膜,可以提高不锈钢的耐腐蚀性.
1相同温度下,取大小相同、表面光亮的锰、镁、铜三种金属片,分别投入足量的、质量分数相同的稀盐酸中(反应中锰的化合价为+2价),现象如表:
| 金属种类 | 锰(Mn) | 镁 | 铜 |
| 与盐酸反应 | 略慢 | 快 | 无明显现象 |
2金属与酸的反应存在某种规律,请你分析下表中的数据,找到对应关系.
| 等质量的金属(a克)与足量盐酸反应 | 镁 | 铁 | 锰 |
| 金属的相对原子质量 | 24 | 56 | 55 |
| 产生氢气的质量(g) | a/12 | a/28 | a/27.5 |
| 找到的规律 | |||

 上述三种金属的活动性由弱到强的顺序是
上述三种金属的活动性由弱到强的顺序是