题目内容
某同学取氯酸钾和二氧化锰混合物15.5 g,加热至完全反应得到10.7 g固体,问10.7 g固体中有哪些物质,各有多少克?
解:10.7 g固体中含有氯化钾和二氧化锰。
根据质量守恒定律生成氧气的质量为:15.5 g-10.7 g=4.8 g
设生成氯化钾的质量为x
2KClO3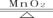 2KCl + 3O2↑
2KCl + 3O2↑
149 96
x 4.8 g
149/96=x/4.8 g
x=149*4.8g/96=7.45 g
则剩余固体中MnO2的质量为:10.7 g-7.45 g=3.25 g
答剩余固体中含有氯化钾7.45 g,含有二氧化锰3.25 g
根据质量守恒定律生成氧气的质量为:15.5 g-10.7 g=4.8 g
设生成氯化钾的质量为x
2KClO3
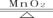 2KCl + 3O2↑
2KCl + 3O2↑149 96
x 4.8 g
149/96=x/4.8 g
x=149*4.8g/96=7.45 g
则剩余固体中MnO2的质量为:10.7 g-7.45 g=3.25 g
答剩余固体中含有氯化钾7.45 g,含有二氧化锰3.25 g
略

练习册系列答案
相关题目


 4Al+3O2。要电解得到54吨铝,需要多少吨氧化铝?
4Al+3O2。要电解得到54吨铝,需要多少吨氧化铝?