题目内容
有一包白色粉末,可能由氯化钠、碳酸钾、硫酸铜、硫酸钠、硝酸钡中的一种或几种组成.为了确定它的组成,某化学小组同学对该白色粉末进行了如下探究活动:
提出假设:白色粉末由上述五种物质组成.
实验探究:
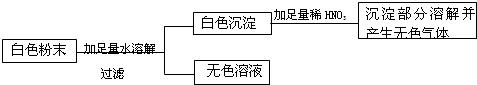
步骤1:取少量白色粉末,加足量水溶解后过滤,得到白色沉淀和无色滤液.
步骤2:取少量沉淀,向其中滴加足量盐酸,部分沉淀溶解,并产生气泡.
获得结论:
(1)原白色粉末中一定没有______(写化学式),说明假设不成立;
(2)步骤1得到的沉淀是______(写化学式);
(3)原白色粉末的组成可能是______、______、______(可以不填满,也可以补充);
(4)为进一步确定原白色粉末的组成,还需进行如下探究:
提出假设:______
| 实验步骤 | 实验现象 | 结论 |
解:(1)把白色粉末溶解后得无色溶液,可知一定没有硫酸铜,因为硫酸铜溶于水会使溶液变蓝;
故答案为:CuSO4;
(2)碳酸钾能和硝酸钡反应生成白色的碳酸钡沉淀,碳酸钡能于酸反应生成气体;硝酸钡和硫酸钠可以反应生成不溶于水且不溶于酸的硫酸钡白色沉淀;而白色沉淀部分溶于稀盐酸中,说明这种白色沉淀是碳酸钡和硫酸钡的混合物,故答案为:BaCO3与 BaSO4的混合物;
(3)根据白色沉淀是硫酸钡和碳酸钡的混合物,那么原白色粉末中含有K2CO3、Na 2SO4、Ba(NO3)2,可能含有NaCl;故答案为:K2CO3、Na 2SO4、Ba(NO3)2或K2CO3、Na 2SO4、Ba(NO3)2、NaCl;
(4)原白色粉末中不能确定的是氯化钠,因此可以假设:原白色粉末中含有NaCl(或不含有NaCl),根据氯离子的检验方法设计实验如下:
故答案为:原白色粉末中含有NaCl(或不含有NaCl);
分析:根据硫酸铜为白色固体,溶于水后其水溶液呈蓝色,碳酸钾能和硝酸钡反应生成白色的碳酸钡沉淀,碳酸钡能于酸反应生成气体;硝酸钡和硫酸钠可以反应生成不溶于水且不溶于酸的白色沉淀分析白色粉末的组成;要仔细分析每一实验步骤的用意及实验中所发生的化学反应,从而做出正确的判断.
点评:本题主要考查盐的性质,要求学生熟练的掌握盐的水溶性,及两种盐之间的反应,并且知道无色的硫酸铜粉末溶于水后得到的溶液呈蓝色,然后根据描述的实验现象逐一验证.
故答案为:CuSO4;
(2)碳酸钾能和硝酸钡反应生成白色的碳酸钡沉淀,碳酸钡能于酸反应生成气体;硝酸钡和硫酸钠可以反应生成不溶于水且不溶于酸的硫酸钡白色沉淀;而白色沉淀部分溶于稀盐酸中,说明这种白色沉淀是碳酸钡和硫酸钡的混合物,故答案为:BaCO3与 BaSO4的混合物;
(3)根据白色沉淀是硫酸钡和碳酸钡的混合物,那么原白色粉末中含有K2CO3、Na 2SO4、Ba(NO3)2,可能含有NaCl;故答案为:K2CO3、Na 2SO4、Ba(NO3)2或K2CO3、Na 2SO4、Ba(NO3)2、NaCl;
(4)原白色粉末中不能确定的是氯化钠,因此可以假设:原白色粉末中含有NaCl(或不含有NaCl),根据氯离子的检验方法设计实验如下:
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量步骤1的滤液,滴加硝酸银溶液和稀硝酸 | 产生白色沉淀(或无现象) | 原白色粉末中含有NaCl(或不含有NaCl) |
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量步骤1的滤液,滴加硝酸银溶液和稀硝酸 | 产生白色沉淀(或无现象) | 原白色粉末中含有NaCl(或不含有NaCl) |
分析:根据硫酸铜为白色固体,溶于水后其水溶液呈蓝色,碳酸钾能和硝酸钡反应生成白色的碳酸钡沉淀,碳酸钡能于酸反应生成气体;硝酸钡和硫酸钠可以反应生成不溶于水且不溶于酸的白色沉淀分析白色粉末的组成;要仔细分析每一实验步骤的用意及实验中所发生的化学反应,从而做出正确的判断.
点评:本题主要考查盐的性质,要求学生熟练的掌握盐的水溶性,及两种盐之间的反应,并且知道无色的硫酸铜粉末溶于水后得到的溶液呈蓝色,然后根据描述的实验现象逐一验证.

练习册系列答案
相关题目
(1)有一包白色粉末,可能是由硫酸铜、氯化钠、碳酸钠、硫酸钠中的一种或几种组成,为检验其中的成分,经实验得到下表,请完成相关内容.
(2)某化学兴趣小组为测定该包白色粉末中碳酸钠的质量分数,取该样品44.6g,加286.2克水溶解制成溶液后投入146克稀盐酸中完全反应,共收集到二氧化碳气体8.8g.求:(1)该碳酸钠样品中碳酸钠的质量分数;(2)反应所得溶液中溶质的质量分数.
| 实验步骤及现象 | 结论 |
| ①将少许白色粉末溶于水得到无色溶液A | 白色粉末中一定没有 |
| ②在A中加入足量硝酸钡溶液,生成白色沉淀B,过滤得滤液C ③在白色沉淀B中加入足量稀硝酸, ④在滤液C中加入硝酸银溶液,出现白色沉淀,再滴加稀硝酸,沉淀不溶解. |
白色粉末中一定有 碳酸钠和氯化钠 |
 (2013?长宁区二模)有一包白色粉末,可能含有K2SO4、Na2CO3、BaCl2、CuSO4中的一种或几种.取样溶于足量的水,有白色沉淀产生,过滤,滤液呈无色;向沉淀中滴加稀盐酸,沉淀的质量与加入盐酸体积的关系如图所示.由此推断白色粉末的成分是( )
(2013?长宁区二模)有一包白色粉末,可能含有K2SO4、Na2CO3、BaCl2、CuSO4中的一种或几种.取样溶于足量的水,有白色沉淀产生,过滤,滤液呈无色;向沉淀中滴加稀盐酸,沉淀的质量与加入盐酸体积的关系如图所示.由此推断白色粉末的成分是( )