题目内容
15、有一包白色粉末,可能含有CaCO3、K2SO4、BaCl2、Na2CO3、Na2SO4等物质,某实验小组对其进行了探究实验,实验过程如下:
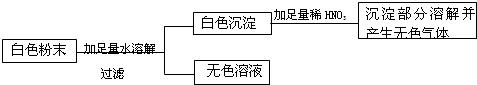
则由此推测此白色粉末,至少由

则由此推测此白色粉末,至少由
3
种物质组成,其中一定含有的物质是BaCl2
.分析:碳酸钙为白色固体,难溶于水,氯化钡和硫酸钾及硫酸钠可以反应生成不溶于水且不溶于酸的白色沉淀;碳酸钠可以和氯化钡反应生成不溶于水但是可以溶于酸的白色固体,在书写可能的组合时,尽可能的根据题意把每一组合写出,要仔细分析每一实验步骤的用意及实验中所发生的化学反应,从而做出正确的判断.
解答:解:把白色粉末溶解后得无色溶液和白色沉淀,白色固体可能是碳酸钙,可能是硫酸钠、硫酸钾与氯化钡反应后生成的硫酸钡沉淀,也可能是碳酸钠和氯化钡反应生成的碳酸钡,其中碳酸钙和碳酸钡能够溶于酸,而硫酸钡不溶于酸,而题目中的白色沉淀部分溶于稀硝酸中,说明这种白色沉淀肯定含有硫酸钡,和碳酸钙或是碳酸钡中的一种,也可能是这两者的混合物,从而可以判断一定含有氯化钡,硫酸钾和硫酸钠至少含有一种,而碳酸钡和碳酸钠至少含有一种,
故本题答案为:3; BaCl2
故本题答案为:3; BaCl2
点评:本题为推断题对于推断题的解法,要根据题给条件和物质的化学特性找准突破口,然后顺藤摸瓜尽可能的把没有组合写出,然后进行解答.

练习册系列答案
相关题目
(1)有一包白色粉末,可能是由硫酸铜、氯化钠、碳酸钠、硫酸钠中的一种或几种组成,为检验其中的成分,经实验得到下表,请完成相关内容.
(2)某化学兴趣小组为测定该包白色粉末中碳酸钠的质量分数,取该样品44.6g,加286.2克水溶解制成溶液后投入146克稀盐酸中完全反应,共收集到二氧化碳气体8.8g.求:(1)该碳酸钠样品中碳酸钠的质量分数;(2)反应所得溶液中溶质的质量分数.
| 实验步骤及现象 | 结论 |
| ①将少许白色粉末溶于水得到无色溶液A | 白色粉末中一定没有 |
| ②在A中加入足量硝酸钡溶液,生成白色沉淀B,过滤得滤液C ③在白色沉淀B中加入足量稀硝酸, ④在滤液C中加入硝酸银溶液,出现白色沉淀,再滴加稀硝酸,沉淀不溶解. |
白色粉末中一定有 碳酸钠和氯化钠 |
 (2013?长宁区二模)有一包白色粉末,可能含有K2SO4、Na2CO3、BaCl2、CuSO4中的一种或几种.取样溶于足量的水,有白色沉淀产生,过滤,滤液呈无色;向沉淀中滴加稀盐酸,沉淀的质量与加入盐酸体积的关系如图所示.由此推断白色粉末的成分是( )
(2013?长宁区二模)有一包白色粉末,可能含有K2SO4、Na2CO3、BaCl2、CuSO4中的一种或几种.取样溶于足量的水,有白色沉淀产生,过滤,滤液呈无色;向沉淀中滴加稀盐酸,沉淀的质量与加入盐酸体积的关系如图所示.由此推断白色粉末的成分是( )