题目内容
鸡蛋壳的主要成分是碳酸钙.为了测定某鸡蛋壳中碳酸钙的质量分数,小群同学进行了如下实验:将鸡蛋壳洗净、干燥并捣碎后,称取10g 放在烧杯里,然后往烧杯中加入足量的稀盐酸90g,充分反应后,称得反应剩余物为96.04g.(假设其他物质不与盐酸反应).计算该鸡蛋壳中碳酸钙的质量分数.
考点:根据化学反应方程式的计算
专题:有关化学方程式的计算
分析:反应后剩余物的总质量比反应前的减少,根据质量守恒定律知,减少的质量就是生成二氧化碳的质量,由二氧化碳的质量根据碳酸钙与盐酸反应的化学方程式可以计算出鸡蛋壳中碳酸钙的质量分数.
解答:解:由质量守恒定律可知该过程中产生二氧化碳的质量为:10g+90g-96.04g=3.96g.
(2)设该鸡蛋壳中碳酸钙的质量为x
CaCO3+2HCl═CaCl2+CO2↑+H2O
100 44
x 3.96g
=
解之得:x=9g
所以鸡蛋壳中碳酸钙的质量分数=
×100%=90%
答:该鸡蛋壳中碳酸钙的质量分数为90%;
(2)设该鸡蛋壳中碳酸钙的质量为x
CaCO3+2HCl═CaCl2+CO2↑+H2O
100 44
x 3.96g
| 100 |
| x |
| 44 |
| 3.96g |
解之得:x=9g
所以鸡蛋壳中碳酸钙的质量分数=
| 9g |
| 10g |
答:该鸡蛋壳中碳酸钙的质量分数为90%;
点评:解答本题的关键是要知道固体质量的减少量就是生成二氧化碳的质量;根据气体的质量算出碳酸钙的质量,再计算质量分数即可.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案
相关题目
下列各组物质的反应必须加入指示剂才能判断反应发生的是( )
| A、氢氧化铜和稀硫酸 |
| B、氢氧化钠和盐酸 |
| C、碳酸钠和盐酸 |
| D、石灰水和二氧化碳 |
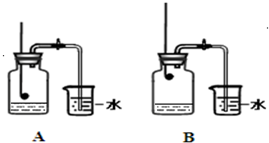 某校化学兴趣小组就空气中氧气的含量进行实验探究.
某校化学兴趣小组就空气中氧气的含量进行实验探究.