题目内容
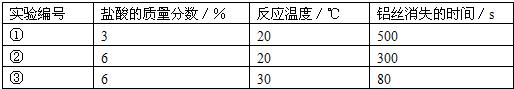
小明选择“铝丝和盐酸反应的快慢与什么因素有关”的课题开展探究.下表是他分别用相同质量的铝丝和足量稀盐酸反应的三组实验数据:| 实验编号 | 盐酸的质量分数/% | 反应温度/℃ | 铝丝消失的时间/s |
| ① | 3 | 20 | 500 |
| ② | 6 | 20 | 300 |
| ③ | 6 | 30 | 80 |
(2)实验②和③表明:该反应快慢与______有关.
(3)能表明盐酸浓度对反应快慢有影响的实验编号是:______和______.
(4)如果把实验①中盐酸的质量分数改为4%,请你推出铝丝消失时间(用t表示)的取值范围:______.
(5)该实验除了用铝丝消失的时间来衡量反应的快慢外,你还能提出新的方法来衡量该反应的快慢吗?方法:______.
【答案】分析:(1)熟练掌握铝与盐酸的反应
(2)比较②和③可以看出它们的不同之处是在于温度
(3)②和③中盐酸浓度相等,故能表明盐酸浓度对反应影响的是①和②
(4)把盐酸浓度改为4%那么此时浓度在3%和6%之间,所以反应所需时间也应该在这之间
(5)计算反应快慢的方法很多,例如产生相同体积的气体的所需时间长短、产生气泡的快慢等都能够衡量反应快慢
解答:解:(1)铝与盐酸反应是置换反应,要生成氢气;
(2)②中盐酸浓度为6%温度为20℃,③中盐酸浓度为6%温度为30℃,可以看出③所需时间较短,从而可以判断温度不同所需时间也不同;
(3)比较①和②中的数据可知浓度越大反应所需时间越短;
(4)浓度为3%所需时间为500秒,浓度为6%所需时间为300秒,那么当浓度为4%时,所需时间应该在300秒至500秒之间;
(5)判断一个反应的快慢有多种方法,有气体产生的可以通过产生气泡的快慢来判断反应的快慢,还可以通过温度升高的快慢来判断等;
故答案为:(1)2Al+6HCl=2AlCl3+3H2↑ (2)温度
(3)①和②(4)300<t<500
(5)用排水法收集一瓶氢气所需时间的多少来衡量(或通过单位时间内生成氢气的量、温度变化来衡量等,其他合理答案均给分)
点评:本题是通过控制不同的量来探究能够影响反应速度的因素的,这类似于物理上所学的控制变量法来解决问题,我们在解答时要注意仔细分析比较,从而得出正确的解答
(2)比较②和③可以看出它们的不同之处是在于温度
(3)②和③中盐酸浓度相等,故能表明盐酸浓度对反应影响的是①和②
(4)把盐酸浓度改为4%那么此时浓度在3%和6%之间,所以反应所需时间也应该在这之间
(5)计算反应快慢的方法很多,例如产生相同体积的气体的所需时间长短、产生气泡的快慢等都能够衡量反应快慢
解答:解:(1)铝与盐酸反应是置换反应,要生成氢气;
(2)②中盐酸浓度为6%温度为20℃,③中盐酸浓度为6%温度为30℃,可以看出③所需时间较短,从而可以判断温度不同所需时间也不同;
(3)比较①和②中的数据可知浓度越大反应所需时间越短;
(4)浓度为3%所需时间为500秒,浓度为6%所需时间为300秒,那么当浓度为4%时,所需时间应该在300秒至500秒之间;
(5)判断一个反应的快慢有多种方法,有气体产生的可以通过产生气泡的快慢来判断反应的快慢,还可以通过温度升高的快慢来判断等;
故答案为:(1)2Al+6HCl=2AlCl3+3H2↑ (2)温度
(3)①和②(4)300<t<500
(5)用排水法收集一瓶氢气所需时间的多少来衡量(或通过单位时间内生成氢气的量、温度变化来衡量等,其他合理答案均给分)
点评:本题是通过控制不同的量来探究能够影响反应速度的因素的,这类似于物理上所学的控制变量法来解决问题,我们在解答时要注意仔细分析比较,从而得出正确的解答

练习册系列答案
相关题目