题目内容
【题目】某化学学习小组做CO还原Fe2O3实验时,查阅资料发现CO还原Fe2O3的实验中若温度不同、受热不均时,除生成Fe外,还会生成Fe3O4。其中Fe3O4为金属氧化物,可与盐酸反应,不与硫酸铜溶液反应。为定量测定生成物的成分,某同学用下图所示的实验方案进行实验并记录数据:
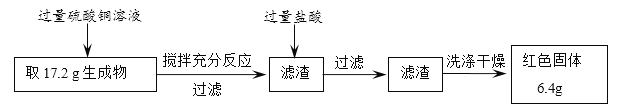
试回答:
(1)写出CO还原Fe2O3生成Fe的化学方程式_____;
(2)过滤操作需要的玻璃仪器是烧杯、玻璃棒和_____;方案中加入过量盐酸的目的是_____;
(3)根据以上实验数据,计算17.2g生成物中Fe3O4的质量为_____。
(4)如得到17.2g生成物,计算参加反应的Fe2O3的质量_____。
【答案】Fe2O3+3CO![]() 2Fe+3CO2 漏斗 除去滤渣中的Fe3O4 11.6g 20g
2Fe+3CO2 漏斗 除去滤渣中的Fe3O4 11.6g 20g
【解析】
(1)CO在高温条件下还原Fe2O3生成Fe和二氧化碳,方程式是:3CO+Fe2O3![]() 2Fe+3CO2;
2Fe+3CO2;
(2)过滤需要的玻璃仪器有烧杯、玻璃棒和漏斗;Fe3O4为金属氧化物,可与盐酸反应,不与硫酸铜溶液反应,所以在生成物中加入过量硫酸铜溶液,发生反应的是铁,过滤后得到的滤渣中含有铜、Fe3O4,再加入过滤盐酸是为了将Fe3O4除尽,得到纯净的铜;
(3)通过反应流程可知:最后得到的红色固体是铜;
设生成6.4g铜需要铁的质量为x

x=5.6g
∴17.2g生成物中Fe3O4的质量为:17.2g-5.6g=11.6g
(4)化学反应前后元素的质量不变,所以生成物中铁元素的质量和参加反应的氧化铁中铁元素的质量是相等的,可利用关系式解答;
设11.6gFe3O4中铁元素的质量为y
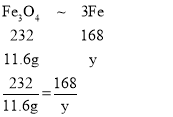
y=8.4g
生成物中铁元素的质量为:8.4g+5.6g=14g
设质量为a的氧化铁中含有14g铁元素
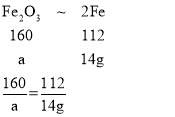
a=20g
答:参加反应的Fe2O3的质量是20g.
故答案为:(1)3CO+Fe2O3![]() 2Fe+3CO2;
2Fe+3CO2;
(2)漏斗;除去滤渣中的Fe3O4;
(3)11.6g;
(4)参加反应的Fe2O3的质量是20g.

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案【题目】工业铁红主要成分是Fe2O3,还含有少量的FeO、Fe3O4。
(查阅资料)草酸晶体(H2C2O43H2O)在浓硫酸作用下受热分解,化学方程式为:H2C2O43H2O![]() CO2↑+CO↑+3H2O,碱石灰是固体NaOH和CaO的混合物,能吸收水蒸气和二氧化碳。铁的常见氧化物中铁的质量分数:
CO2↑+CO↑+3H2O,碱石灰是固体NaOH和CaO的混合物,能吸收水蒸气和二氧化碳。铁的常见氧化物中铁的质量分数:
铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
铁的质量分数 | 77.8% | 70.0% | 72.4% |
(问题讨论)为了测定铁红中铁元素的质量分数,小组间学进行如下实验。(装置气密性良好)

(1)该实验为了保证进入E中的气体是纯净、干燥的CO,则B、C、D中的试剂依次是_____(填字母序号)
a.浓硫酸 b.澄清的石灰水 c氢氧化钠溶液
(2)写出E装置中所发生反应的一个化学方程式:_____。
(3)称取铁红样品10.0g,用上述装置进行实验,测定铁红中铁的质量分数。
①若E中充分反应后得到铁粉的质量为mg,则_____<m<_____。
②若实验前后称得F装置増重7.7g,则此铁红中铁的质量分数是_____。
(实验反思)
(4)如果缺少G装置(不考虑其他因素),则测得样品中铁的质量分数会_____(选填“偏小”“不变”“偏大”)。
(5)该实验装置的一个明显缺陷是_____。
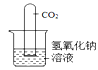
【题目】实验室用石灰水而不用氢氧化钠溶液鉴定二氧化碳。氢氧化钠能否与二氧化碳反应?
(查阅资料)(1).氢氧化钠溶液与二氧化碳反应生成易溶的碳酸钠,碳酸钠在二氧化碳过量的条件下继续与水和二氧化碳反应生成碳酸氢钠
(2).碳酸钠和碳酸氢钠性质对比如下表
操作 | NaHCO3溶液 | Na2CO3溶液 |
加入稀盐酸 | 产生气泡 | 产生气泡 |
加入稀CaCl2溶液 | 无明显变化 | __________________(填写现象) |
加热溶液至沸腾,并将气体通入澄清石灰水 | 澄清石灰水变浑浊 | 澄清石灰水无明显变化 |
(进行实验)
实验操作 | 化学方程式 | 结论及实验现象 |
| ____________ | 氢氧化钠与二氧化碳反应生成碳酸钠,写出该反应化学方程式:_________________ |
(实验反思)学习小组同学经过分析讨论,认为产生此实验现象的原因可能有两种:
一种是NaOH与CO2发生了反应; 另一种是_______________________
(2) 为了进一步验证CO2与NaOH溶液已经发生反应,请你设计一个简单的实验检验生成的新物质。
实验步骤 | 实验现象 | 解释与结论 |
_________ | _____________ | NaOH与CO2发生了反应 |
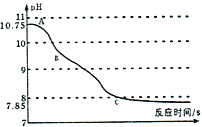
(实验拓展)该小组同学将二氧化碳通入氢氧化钠溶液中,利用数字化技术测定溶液pH值变化,待完全反应后,观察到溶液中逸出大量气泡,pH出现两段S型变化曲线。
(实验分析)
(3)AB段变化的原因可能是______________。
BC段变化的原因可能是______________。
实验操作为________________。
实验现象是_________________。