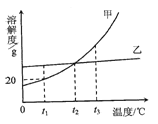
题目内容
【题目】将一定量甲烷和氧气置于密闭容器中引燃,测得反应前后各物质的质量如下表:
物质 | 甲烷 | 氧气 | 水 | 二氧化碳 | X |
反应前质量/g | 4.8 | 16 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 10.8 | 4.4 | a |
下列判断正确的是
A.X可能是反应物 B.X可能是该反应的催化剂
C.X中含有氢元素 D.氧气增加能减少X的生成
【答案】D
【解析】
试题分析∶由题中信息知,应是甲烷的不充分燃烧。X不可能是反应物。故A错误。B.X更不可能是该反应的催化剂。故B错误。C.X中含有碳,氧元素。故C错误。D.氧气增加能减少X的生成。
故D正确。
考点∶考查质量守恒定律的灵活应用。

【题目】实验与探究是化学学习的重要方法和内容,李明看到家里多年未用的铜制火锅上有绿色的锈迹,他对绿色锈迹的成分和性质产生了浓厚兴趣。
【查阅资料】
①绿色锈迹是碱式碳酸铜[Cu2(OH)2CO3],受热易分解;
②无水硫酸铜为白色粉末,遇水变蓝;
③碱石灰是CaO和NaOH的固体混合物,NaOH与CO2反应生成碳酸钠固体和水;
④氧化铜与稀硫酸反应生成蓝色溶液,碳粉不与稀硫酸反应也不溶解在稀硫酸中。
【发现问题】
查阅资料后,该同学将少量碱式碳酸铜放入试管中加热,发现试管中的固体由绿色变成黑色,同时试管壁上有无色液滴生成。
为了进一步确定碱式碳酸铜受热分解的产物,进行了如下探究:
探究一:碱式碳酸铜受热分解生成的黑色固体成分。
【猜想与假设】该黑色固体可能是①碳粉;② ;③碳和氧化铜的混合物。
【设计方案】请帮助该同学完成下述实验报告:
实验操作与现象 | 实验结论 |
猜想②正确 |
探究二:碱式碳酸铜受热分解还会生成CO2和H2O.
【进行实验】选择如下图所示装置进行验证:
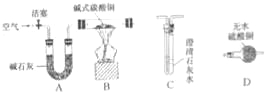
步骤一:连接A和B,打开活塞,通入一段时间的空气;
步骤二:点燃酒精灯,依次连接装置A→B→ → (填“C”,“D”);
步骤三:点燃酒精灯,观察到明显现象后,停止加热。
【解释与结论】
①当观察到 ,说明碱式碳酸铜受热分解生成了CO2和H2O,写出装置C中反应的化学方程式 ;
②写出Cu2(OH)2CO3受热分解的化学方程式 。
【反思与评价】
上述装置中A的作用是 。