题目内容
把干燥、纯净的10g高锰酸钾装入试管中,加热制取氧气.反应一段时间后停止加热,待试管冷却后,称得试管内的固体剩余物为9.36g.计算:(1)制得氧气的质量是多少?
(2)9.36g固体剩余物中含有哪些物质?它们的质量各是多少?
【答案】分析:高锰酸钾受热分解后生成锰酸钾、二氧化锰和氧气,由于氧气逸出,所以反应后固体质量会减少;根据质量守恒定律可知,固体质量的减少量即为生成氧气的质量,然后根据反应方程式由氧气的质量求出参加反应的高锰酸钾及生成的锰酸钾和二氧化锰的质量.
解答:解:(1)m(O2)=10g-9.36g=0.64g
(2)设参加反应的KMnO4质量为x,反应生成的K2MnO4质量为y、MnO2质量分别为z.
2KMnO4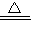 K2MnO4 +MnO2 +O2↑
K2MnO4 +MnO2 +O2↑
316 197 87 32
x y z 0.64g
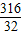 =
=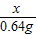 x=6.32g
x=6.32g
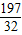 =
=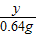 y=3.94g
y=3.94g
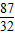 =
=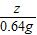 z=1.74g
z=1.74g
未反的KMnO4质量为10g-6.32g=3.68g
答:(1)制得氧气的质量是0.64g;
(2)9.36g固体剩余物中含有KMnO4的质量为3.68g、K2MnO4的质量为3.94g、MnO2的质量为1.74g.
点评:此题考查的根据关化学方程式的计算,通过认真分析题干,直接得到氧气的质量,然后再求其他反应物的质量.此题计算量较大,计算一定要细心准确.
解答:解:(1)m(O2)=10g-9.36g=0.64g
(2)设参加反应的KMnO4质量为x,反应生成的K2MnO4质量为y、MnO2质量分别为z.
2KMnO4
 K2MnO4 +MnO2 +O2↑
K2MnO4 +MnO2 +O2↑316 197 87 32
x y z 0.64g
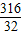 =
=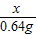 x=6.32g
x=6.32g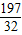 =
=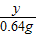 y=3.94g
y=3.94g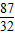 =
=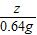 z=1.74g
z=1.74g未反的KMnO4质量为10g-6.32g=3.68g
答:(1)制得氧气的质量是0.64g;
(2)9.36g固体剩余物中含有KMnO4的质量为3.68g、K2MnO4的质量为3.94g、MnO2的质量为1.74g.
点评:此题考查的根据关化学方程式的计算,通过认真分析题干,直接得到氧气的质量,然后再求其他反应物的质量.此题计算量较大,计算一定要细心准确.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目