题目内容
工人师傅要用98%的浓硫酸(ρ=1.84g/cm3)稀释成15%的稀硫酸来清洗钢铁表面的铁锈(水的密度约为ρ=1g/cm3).求:
(1)54.4mL这样的浓硫酸中溶质的质量为________,这些溶质中含氧元素的质量为________.
(2)将这些浓硫酸稀疏成15%的稀硫酸,需水的体积为________.
(3)这些稀硫酸和金属反应能产生氢气的质量为________.(本题计算结果精确到1g)
解:(1)54.4mL这样的浓硫酸质量是54.4cm3×1.84g/cm3=100g,则含硫酸的质量为100g×98%=98g,含有的氧元素质量是98g×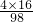 =64g;
=64g;
(2)设加水的质量是x,则有98g=(x+100g)×15%,x=533g体积是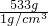 =533mL;
=533mL;
(3)假设这些硫酸是与锌反应,则设生成的氢气质量是y
Zn+H2SO4=ZnSO4+H2↑
98 2
98g y
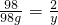
y=2g
故答案为:(1)98g;64g;(2)533mL;(3)2g;
分析:(1)依据溶液的体积和密度可以计算溶液的质量,而后利用溶质的质量分数可求出溶质的质量,利用硫酸中氧的质量分数可求出氧元素的质量;
(2)利用稀释前后溶质的质量不变可以求出水的质量进而求出水的体积;
(3)利用硫酸的质量结合硫酸与金属(可以是锌等)的方程式计算即可(也可以采用化学式进行计算);
点评:本题主要考查学生对浓硫酸相关知识的运用,重点是考查质量分数公式和密度公式进行计算的能力.
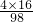 =64g;
=64g;(2)设加水的质量是x,则有98g=(x+100g)×15%,x=533g体积是
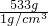 =533mL;
=533mL;(3)假设这些硫酸是与锌反应,则设生成的氢气质量是y
Zn+H2SO4=ZnSO4+H2↑
98 2
98g y
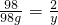
y=2g
故答案为:(1)98g;64g;(2)533mL;(3)2g;
分析:(1)依据溶液的体积和密度可以计算溶液的质量,而后利用溶质的质量分数可求出溶质的质量,利用硫酸中氧的质量分数可求出氧元素的质量;
(2)利用稀释前后溶质的质量不变可以求出水的质量进而求出水的体积;
(3)利用硫酸的质量结合硫酸与金属(可以是锌等)的方程式计算即可(也可以采用化学式进行计算);
点评:本题主要考查学生对浓硫酸相关知识的运用,重点是考查质量分数公式和密度公式进行计算的能力.

练习册系列答案
相关题目
 都有钢铁制造。铁在________________
都有钢铁制造。铁在________________