题目内容
(2012?宁德)K2CO3和KNO3是重要的盐类物质.其溶液应用广泛.
Ⅰ.(1)K2CO3溶液的酸碱性和Na2CO3溶液相似,能使无色酚酞溶液变
(2)K2CO3和KNO3在不同温度时的溶解度如下:
①图1中表示KNO3溶解度曲线的是
②20℃时,K2CO3饱和溶液中溶质与溶剂的质量比为
Ⅱ.某KNO3样品中含有少量K2CO3,其提纯流程如图2:
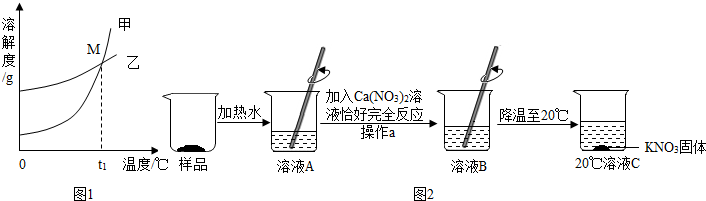
(1)溶液A加入适量Ca(NO3)2溶液,与溶液中K2CO3恰好完全反应,生成CaCO3沉淀和KNO3,写出该反应的化学方程式:
(2)操作a的名称是
(3)20℃时溶液C是
Ⅰ.(1)K2CO3溶液的酸碱性和Na2CO3溶液相似,能使无色酚酞溶液变
红
红
色.(2)K2CO3和KNO3在不同温度时的溶解度如下:
| 温度/℃ | 20 | 30 | 50 | 60 | 80 | |
| 溶解度/g | K2CO3 | 110 | 114 | 121 | 126 | 139 |
| KNO3 | 31.6 | 45.8 | 85.5 | 110 | 169 | |
甲
甲
(填“甲”或“乙”).②20℃时,K2CO3饱和溶液中溶质与溶剂的质量比为
11:10
11:10
.Ⅱ.某KNO3样品中含有少量K2CO3,其提纯流程如图2:

(1)溶液A加入适量Ca(NO3)2溶液,与溶液中K2CO3恰好完全反应,生成CaCO3沉淀和KNO3,写出该反应的化学方程式:
K2CO3+Ca(NO3)2=CaCO3↓+2KNO3
K2CO3+Ca(NO3)2=CaCO3↓+2KNO3
.(2)操作a的名称是
过滤
过滤
.(3)20℃时溶液C是
饱和溶液
饱和溶液
(填“饱和溶液”或“不饱和溶液”).分析:Ⅰ(1)根据K2CO3溶液和Na2CO3溶液都呈碱性,都能使无色酚酞溶液变红进行解答;
(2)①比较甲乙的溶解度变化趋势结合图中表格数据可以作出判断;
②根据20℃时碳酸钾的溶解度结合溶解度的定义进行解答;
Ⅱ(1)根据Ca(NO3)2溶液与溶液中K2CO3恰好完全反应,生成CaCO3沉淀和KNO3进行解答;
(2)根据操作2后的得到物质为固体和液体可以做出判断;
(3)根据饱和溶液的定义进行判断.
(2)①比较甲乙的溶解度变化趋势结合图中表格数据可以作出判断;
②根据20℃时碳酸钾的溶解度结合溶解度的定义进行解答;
Ⅱ(1)根据Ca(NO3)2溶液与溶液中K2CO3恰好完全反应,生成CaCO3沉淀和KNO3进行解答;
(2)根据操作2后的得到物质为固体和液体可以做出判断;
(3)根据饱和溶液的定义进行判断.
解答:解:Ⅰ(1)K2CO3溶液和Na2CO3溶液都呈碱性,都能使无色酚酞溶液变红;
(2)①根据溶解度曲线可以知道,在温度较低时硝酸钾的溶解度较小,结合图中的两条溶解度曲线可以知道甲表示的是硝酸钾的溶解度曲线;
②20℃时碳酸钾的溶解度为110g,根据溶解度的定义有可以知道:该温度下K2CO3饱和溶液中溶质与溶剂的质量比:110g:100g=11:10;
Ⅱ(1)Ca(NO3)2溶液与溶液中K2CO3恰好完全反应,生成CaCO3沉淀和KNO3,该反应的化学方程式:Ca(NO3)2+K2CO3=CaCO3↓+2KNO3;
(2)操作2后得到了固体和液体,所以可以判断操作2为过滤;
(3)根据表中数据可以知道在50℃时,硝酸钾的溶解度为85.5g,而20℃时硝酸钾的溶解度为31.6g,结合操作2后得到了53.9g硝酸钾固体,而85.5g-31.6g=53.9g,所以可以判断B和C都为饱和溶液;
故答案为:
Ⅰ.(1)红;(2)①甲;②11:10;
Ⅱ.(1)Ca(NO3)2+K2CO3=CaCO3↓+2KNO3;
(2)过滤;(3)饱和溶液.
(2)①根据溶解度曲线可以知道,在温度较低时硝酸钾的溶解度较小,结合图中的两条溶解度曲线可以知道甲表示的是硝酸钾的溶解度曲线;
②20℃时碳酸钾的溶解度为110g,根据溶解度的定义有可以知道:该温度下K2CO3饱和溶液中溶质与溶剂的质量比:110g:100g=11:10;
Ⅱ(1)Ca(NO3)2溶液与溶液中K2CO3恰好完全反应,生成CaCO3沉淀和KNO3,该反应的化学方程式:Ca(NO3)2+K2CO3=CaCO3↓+2KNO3;
(2)操作2后得到了固体和液体,所以可以判断操作2为过滤;
(3)根据表中数据可以知道在50℃时,硝酸钾的溶解度为85.5g,而20℃时硝酸钾的溶解度为31.6g,结合操作2后得到了53.9g硝酸钾固体,而85.5g-31.6g=53.9g,所以可以判断B和C都为饱和溶液;
故答案为:
Ⅰ.(1)红;(2)①甲;②11:10;
Ⅱ.(1)Ca(NO3)2+K2CO3=CaCO3↓+2KNO3;
(2)过滤;(3)饱和溶液.
点评:主要考查了固体溶解度的概念、固体溶解度和其饱和溶液中溶质的质量分数及固体溶解度曲线所表示的意义,以此培养学生的分析能力和解决问题的能力.

练习册系列答案
相关题目
 (2012?宁德质检)化石能源的过度开发和消耗,使能源成为当今世界日益关注的热点问题之一.
(2012?宁德质检)化石能源的过度开发和消耗,使能源成为当今世界日益关注的热点问题之一.
 (2012?宁德质检)工业纯碱中常含有少量的NaCl杂质.右下图是测定纯碱样品中Na2CO3质量分数的实验装置,反应的化学方程式为:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑.(装置气密性良好,纯碱样品质量为11.0g,装置D反应前的质量为172.2g).
(2012?宁德质检)工业纯碱中常含有少量的NaCl杂质.右下图是测定纯碱样品中Na2CO3质量分数的实验装置,反应的化学方程式为:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑.(装置气密性良好,纯碱样品质量为11.0g,装置D反应前的质量为172.2g).