��Ŀ����
����Ŀ������ʯ������������������ҽҩ��ƿ����ѧ������ԭ�ϣ�ij��ȤС�����̽����
���������ϡ�����ʯ����̼���ο����Ҫ�ɷֵĻ�ѧʽ�ɱ�ʾΪ��xMgCO3 yCaCO3���� �����Ƕ������裬�䲻����ˮ��Ҳ�������ᷴӦ�����Ȳ��ֽ⣩
һ������̽��������ʯ�۵ijɷ�
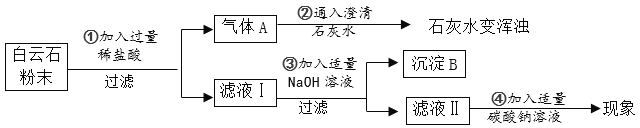
��ʵ�������
��1�����˲������õ��IJ��������в��������ձ���_________��
��2���ɲ���٢ڵ�����ɵó�����ʯ����һ�����е�������________�������ӷ��ţ���
��3�����������������þ�Ļ�ѧ����ʽ��_________������ܵķ�Ӧ������________��
���� �ۡ�����ʯ��̼��ơ�̼��þ��ɡ�
��ʵ�����ɡ���������������ˮ���Զ����ⶨ����ʯ�۵���ɸ��Žϴ�����ʦ��ָ���¸���ȤС������ȷֽⷨ���ж���̽����
��������̽��������ʯ�����
���������ϡ�̼��ƿ�ʼ�ֽ���¶�Ϊ898��,1000��ʱ��ȫ�ֽ�������ʯ�ҺͶ�����̼���壻̼�����̼��þ�Ļ�ѧ�������ƣ�̼��þ��ʼ�ֽ���¶�Ϊ540�棬700��ʱ��ȫ�ֽ⡣
��ʵ����ơ�Ϊ�ⶨ����ʯ�еĺ�������x��y��ֵ����С�����������װ�ò�����ʵ�飺
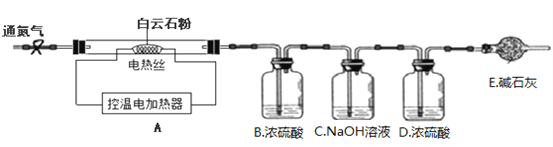
��ʵ�鲽�衿
����װ���������װ�õ������ԣ�
��ȷ��ȡ30.0g ����ʯ��ĩ����Aװ���У����ɼУ�����һ��ʱ�䵪����������
�۹رյ��ɼУ����µ�����������������¶���700�棬���������������������䣻
�ܴ��ɼУ���������һ��ʱ�䵪����ȷ����B��C��D��Eװ�õ�������
�ݹرյ��ɼУ������¶���1000�棬���������������������䣬���ɼУ���������һ��ʱ�䵪����ȷ����B��C��D��Eװ�õ�������
ʵ�����ݼ�¼�����
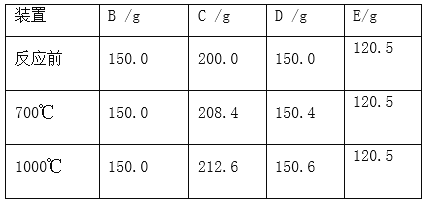
��ʵ����������ݴ�����
��4��װ��D��������_____________��
��5�����������������������������һ��ʱ�䵪����Ŀ����_________��
��6���������ʯ�и�Ԫ�ص�����������д��������̣���___________��
��7�����ʵ��֤������ʯ������ȫ�ֽ��ʵ�鷽����________��д��ʵ�鷽���������ۣ���
��8������ʯ��xMgCO3 yCaCO3���е� x��y=_____����������ȣ���������ǰû�й���һ��ʱ��ĵ��������ᵼ��x��y��ֵ________ ����ƫ��ƫС�䣩��
���𰸡� ©�� CO32- MgCl2+2NaOH == Mg(OH)2��+2NaCl ������ɫ���� ���յ���������ˮ��������ֹ��ö�����̼������ƫС ʹ������װ���ڵĶ�����̼����ȫ����Cװ�����գ����������������÷֣� 13.3% ȡ������Ӧ��������Թ��У�����������ϡ���ᣬ�����ݲ���������ȫ�ֽ� 2:1 �������10��ƫ��
��������������̽������ʯ�ɷֵ��龳�¿�����̼������ӵļ��飬�����ķ�Ӧ��ʵ�����ݵķ��������ݻ�ѧ����ʽ���м��㲢���з������ۺ��Խ�ǿ��
��1�����˲������õ��IJ��������в��������ձ���©����
��2��̼��������ܺ������ӽ�ϳ�ˮ�Ͷ�����̼������ɲ���٢ڵ�����ɵó�����ʯ����һ�����е�������CO32����
��3��������У��Ȼ�þ���������Ʒ�Ӧ���ɰ�ɫ����������þ���Ȼ��ƣ���Ӧ�Ļ�ѧ����ʽΪ��MgCl2+2NaOH�TMg��OH��2��+2NaCl���Ȼ����ܺ�̼���Ʒ�Ӧ���ɰ�ɫ����̼��ƺ��Ȼ��ƣ�ʵ�������Dz�����ɫ������
��4��װ��D�������е�Ũ���������յ���������ˮ��������ֹ��ö�����̼������ƫС��
��5�����������������������������һ��ʱ�䵪����Ŀ����ʹ������װ���ڵĶ�����̼����ȫ����Cװ��������
��6����̼��Ƶ�����Ϊx��
̼��Ʒֽ����ɶ�����̼������(212.6-208.4)g+(150.6-15.04)g=4.4g��
CaCO3![]() CaO+CO2����
CaO+CO2����
100 44
x 4.4g
![]() =
=![]() ��
��
x=10g��
10g̼����и�Ԫ�ص�������10��![]() 100%��4g
100%��4g
�أ�Ca���T4g/30g�T13.3%
�𣺰���ʯ�и�Ԫ�ص���������Ϊ13.3%��
��7����Ӧ��Ĺ�����û��̼��ƺ�̼��þ��˵������ȫ�ֽ⣬ʵ��֤������ʯ������ȫ�ֽ��ʵ�鷽���ǣ�ȡ������Ӧ��������Թ��У�����������ϡ���ᣬ�����ݲ�����˵����ȫ�ֽ���
��8����̼��þ����Ϊy��
̼��þ�ֽ����ɶ�����̼����������208.4-2000��g+��150.4-150��g=8.8g��
MgCO3![]() MgO+CO2����
MgO+CO2����
84 44
y 8.8g
![]() =
=![]() ��
��
y=16.8g��
���������� ![]() =
=![]() x��y=2��1
x��y=2��1
������ǰû�й���һ��ʱ��ĵ����������еĶ�����̼������̼��þ�ֽ����ɵĶ�����̼����ƫ�Ӷ��ᵼ��x��y��ֵƫ����


