题目内容
【题目】化学兴趣小组对“影响过氧化氢分解反应速率的因素﹣﹣过氧化氢的质量分数和二氧化锰的用量”进行如下的实验探究,请你参与.
【进行实验】
在室温下,选用10mL不同溶质质量分数的过氧化氢溶液(5%和10%)分别与0.2g、0.8g和1.0g的二氧化锰粉末进行实验.
(1)过氧化氢分解反应的化学方程式为 .
(2)用如图1所示装置收集并测量氧气的体积,其中量筒的作用是 , 氧气应从(选填e或f)管通入,再与g相连.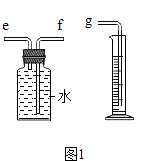
(3)【数据处理】
实验小组进行实验后,获得的相关实验数据如表所示:
实验编号 | 过氧化氢的质量分数 | 二氧化锰粉末 | 氧气的体积(mL) |
a | 5% | 0.2g | 65.8 |
b | 5% | 0.8g | 85.7 |
c | 5% | 1.0g | 85.7 |
d | 10% | 0.2g | 121.9 |
e | 10% | 0.8g | 171.5 |
f | 10% | 1.0g | 171.5 |
①若要检验上述实验收集到的气体是否为氧气,方法是 .
②要比较不同质量分数的过氧化氢溶液对反应快慢的影响,应选择的实验编号是(写一组).由此可以得出的结论是:在催化剂、温度相同的条件下,过氧化氢的质量分数 .
③从上述实验中得出二氧化锰的用量对反应速率影响的结论是:在过氧化氢溶液的质量分数、温度相同的条件下,在一定的范围内,MnO2的用量越大,反应越 .
(4)【拓展延伸】
如图2是兴趣小组在记录生成氧气气体体积与对应时间的曲线,从曲线可以看出反应的速率逐渐变小,其原因是 . 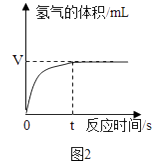
(5)你认为影响过氧化氢分解反应速率的因素还有 , 请设计实验方案验证你的猜想 .
【答案】
(1)2H2O2 ![]() 2H2O+O2↑
2H2O+O2↑
(2)根据进入量筒中水的体积,判断生成氧气的体积,e
(3)将带火星的木条伸入集气瓶中,若带火星的木条复燃,则证明是氧气,②,越大,反应速度越快,快
(4)随着反应过氧化氢的质量分数变小,反应速度变慢
(5)催化剂种类,取浓度相同、质量相同的过氧化氢溶液分别加入不同种类的同质量的催化剂进行实验,测定收集150mL氧气所需的时间即可
【解析】解:(1)过氧化氢分解产生水和氧气,反应的方程式为:2H2O2 ![]() 2H2O+O2↑;(2)因为氧气不易溶于水,可以通过压强的变化利用排水法把水压入量筒内,根据进入量筒中水的体积,判断生成氧气的体积,故进气管是短管e;(3)①氧气能支持燃烧,故检验氧气将带火星的木条伸入集气瓶中,若带火星的木条复燃,则证明是氧气;②ad中过氧化氢溶液质量分数不同,而其它量相同,所以能比较不同质量分数的过氧化氢溶液对反应快慢的影响,得出的结论是:在催化剂、温度相同的条件下,过氧化氢的质量分数越大,反应速度越快;③观察图表可知,二氧化锰粉末的量越多等时间收集氧气的体积越多;同时还看出二氧化锰的量增加到一定量后,不再影响过氧化氢分解的速率.所以结论是:在过氧化氢溶液的质量分数、温度相同的条件下,在一定的范围内,MnO2的用量越大,反应越快;(4)从上面实验得到的结论是:在催化剂、温度相同的条件下,过氧化氢的质量分数越大,反应速度越快,从曲线可以看出反应的速率逐渐变小,因为开始过氧化氢的质量分数大,反应速度快,随着反应过氧化氢的质量分数变小,反应速度变慢,故填:随着反应过氧化氢的质量分数变小,反应速度变慢;(5)影响过氧化氢分解速率的因素还有催化剂的种类.可以取浓度相同、质量相同的过氧化氢溶液分别加入不同种类的同质量的催化剂进行实验,测定收集150mL氧气所需的时间即可.所以答案是:催化剂种类;取浓度相同、质量相同的过氧化氢溶液分别加入不同种类的同质量的催化剂进行实验,测定收集150mL氧气所需的时间即可.所以答案是:(1)2H2O2
2H2O+O2↑;(2)因为氧气不易溶于水,可以通过压强的变化利用排水法把水压入量筒内,根据进入量筒中水的体积,判断生成氧气的体积,故进气管是短管e;(3)①氧气能支持燃烧,故检验氧气将带火星的木条伸入集气瓶中,若带火星的木条复燃,则证明是氧气;②ad中过氧化氢溶液质量分数不同,而其它量相同,所以能比较不同质量分数的过氧化氢溶液对反应快慢的影响,得出的结论是:在催化剂、温度相同的条件下,过氧化氢的质量分数越大,反应速度越快;③观察图表可知,二氧化锰粉末的量越多等时间收集氧气的体积越多;同时还看出二氧化锰的量增加到一定量后,不再影响过氧化氢分解的速率.所以结论是:在过氧化氢溶液的质量分数、温度相同的条件下,在一定的范围内,MnO2的用量越大,反应越快;(4)从上面实验得到的结论是:在催化剂、温度相同的条件下,过氧化氢的质量分数越大,反应速度越快,从曲线可以看出反应的速率逐渐变小,因为开始过氧化氢的质量分数大,反应速度快,随着反应过氧化氢的质量分数变小,反应速度变慢,故填:随着反应过氧化氢的质量分数变小,反应速度变慢;(5)影响过氧化氢分解速率的因素还有催化剂的种类.可以取浓度相同、质量相同的过氧化氢溶液分别加入不同种类的同质量的催化剂进行实验,测定收集150mL氧气所需的时间即可.所以答案是:催化剂种类;取浓度相同、质量相同的过氧化氢溶液分别加入不同种类的同质量的催化剂进行实验,测定收集150mL氧气所需的时间即可.所以答案是:(1)2H2O2 ![]() 2H2O+O2↑;(2)根据进入量筒中水的体积,判断生成氧气的体积;e;(3)①将带火星的木条伸入集气瓶中,若带火星的木条复燃,则证明是氧气;②越大,反应速度越快;③快;(4)随着反应过氧化氢的质量分数变小,反应速度变慢;(5)催化剂种类;取浓度相同、质量相同的过氧化氢溶液分别加入不同种类的同质量的催化剂进行实验,测定收集150mL氧气所需的时间即可.
2H2O+O2↑;(2)根据进入量筒中水的体积,判断生成氧气的体积;e;(3)①将带火星的木条伸入集气瓶中,若带火星的木条复燃,则证明是氧气;②越大,反应速度越快;③快;(4)随着反应过氧化氢的质量分数变小,反应速度变慢;(5)催化剂种类;取浓度相同、质量相同的过氧化氢溶液分别加入不同种类的同质量的催化剂进行实验,测定收集150mL氧气所需的时间即可.
【考点精析】解答此题的关键在于理解氧气的检验和验满的相关知识,掌握氧气的验满:用带火星的木条放在集气瓶口;检验:用带火星的木条伸入集气瓶内,以及对催化剂的特点与催化作用的理解,了解催化剂(触媒):在化学反应中能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质.(一变两不变)催化剂在化学反应中所起的作用叫催化作用.

 53随堂测系列答案
53随堂测系列答案
