题目内容
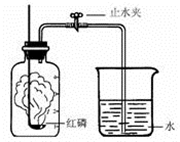 某同学设计了测定空气中氧气含量的实验,实验装置如右图.该同学的实验步骤如下:
某同学设计了测定空气中氧气含量的实验,实验装置如右图.该同学的实验步骤如下:①将图中的集气瓶分为5等份,并作好标记.
②在带橡皮塞和导管的燃烧匙内装入足量的红磷,将导管上的止水夹夹紧,在酒精灯上点燃红磷,并立即伸入集气瓶内,塞紧橡皮塞.
③充分反应后,待集气瓶冷却至室温,打开止水夹.
请回答下列问题:
(1)该实验中红磷需稍过量,目的是
使空气中的氧气全部消耗完
使空气中的氧气全部消耗完
;(2)步骤③中打开止水夹后观察到的现象是
烧杯中的水倒流至集气瓶,液面上升在一等分刻度处
烧杯中的水倒流至集气瓶,液面上升在一等分刻度处
;由此可得出空气中氧气的体积分数约为| 1 |
| 5 |
| 1 |
| 5 |
氮气不溶于水
氮气不溶于水
;(3)若将红磷换成木炭,该实验能否获得成功
否
否
(填“能”或“否”)?理由是木炭燃烧后生成了二氧化碳气体,瓶内压强基本不变
木炭燃烧后生成了二氧化碳气体,瓶内压强基本不变
.(4)若进入集气瓶的水的体积明显少于1/5,则可能是①
红磷的量不足
红磷的量不足
;②装置漏气
装置漏气
.分析:本题是测定空气中氧气的含量,我们常用燃烧红磷或白磷的方法,因为磷燃烧生成白色固体五氧化二磷,几乎不占空间,使得内外产生气压差,从而得到正确的结论.因此在选择可燃物时,必须考虑到:燃烧的条件;生成物的状态;不与空气中其他物质发生反应.保证本实验成功的关键是:①装置气密性好;②红磷要足量;③要冷却至室温再读数.
解答:解:(1)实验的目的是测定空气中氧气含量,原理是消耗氧气使装置内外产生压强差,水被吸入占据氧气的空间,从而达到测定氧气的目的,红磷过量,可使集气瓶中的氧气完全消耗;
故答案为:使空气中的氧气全部消耗完;
(2)红磷与氧气反应,生成了五氧化二磷固体,所以会导致集气瓶内压强减小,水被压入集气瓶,进入的水量正好占据集气瓶内氧气的空间,约为集气瓶体积的五分之一;据实验现象可得出空气中氧气的体积分数约为五分之一;剩余的气体主要是氮气,水进入瓶内占五分之一,不再继续进入说明氮气不能与红磷反应,也不能溶于水或与水反应;
故答案为:烧杯中的水倒流至集气瓶,液面上升在一等分刻度处;
;氮气不溶于水;
(3)测定空气中氧气的体积分数利用的是压强的改变,所以若把红磷换成木炭,木炭和氧气反应又生成二氧化碳,没有改变集气瓶内的压强,达不到实验目的;
故答案为:否;木炭燃烧后生成了二氧化碳气体,瓶内压强基本不变;
(4)红磷的量不足,使瓶内氧气未耗尽; 装置漏气,使外界空气进入瓶内; 未冷却至室温就打开止水夹,使进入瓶内水的体积减少;烧杯中的水不够等都会使进入的水少于五分之一;
故答案为:红磷的量不足;装置漏气.
故答案为:使空气中的氧气全部消耗完;
(2)红磷与氧气反应,生成了五氧化二磷固体,所以会导致集气瓶内压强减小,水被压入集气瓶,进入的水量正好占据集气瓶内氧气的空间,约为集气瓶体积的五分之一;据实验现象可得出空气中氧气的体积分数约为五分之一;剩余的气体主要是氮气,水进入瓶内占五分之一,不再继续进入说明氮气不能与红磷反应,也不能溶于水或与水反应;
故答案为:烧杯中的水倒流至集气瓶,液面上升在一等分刻度处;
| 1 |
| 5 |
(3)测定空气中氧气的体积分数利用的是压强的改变,所以若把红磷换成木炭,木炭和氧气反应又生成二氧化碳,没有改变集气瓶内的压强,达不到实验目的;
故答案为:否;木炭燃烧后生成了二氧化碳气体,瓶内压强基本不变;
(4)红磷的量不足,使瓶内氧气未耗尽; 装置漏气,使外界空气进入瓶内; 未冷却至室温就打开止水夹,使进入瓶内水的体积减少;烧杯中的水不够等都会使进入的水少于五分之一;
故答案为:红磷的量不足;装置漏气.
点评:在做测定空气中氧气的体积分数实验时选择的药品只能跟空气中的氧气反应不能跟其它物质发生反应,同时还不能产生气体.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 (2005?崇文区二模)某同学设计了测定空气中氧气含量的实验,实验装置如图.该同学的实验步骤如下:
(2005?崇文区二模)某同学设计了测定空气中氧气含量的实验,实验装置如图.该同学的实验步骤如下:
 某同学设计了测定空气中氧气含量的实验,实验装置如图所示.该同学的实验步骤如下:
某同学设计了测定空气中氧气含量的实验,实验装置如图所示.该同学的实验步骤如下: 某同学设计了测定空气中氧气含量的实验,实验装置如图.
某同学设计了测定空气中氧气含量的实验,实验装置如图.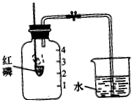 某同学设计了测定空气中氧气含量的实验,装置如图,该同学的实验步骤如下:
某同学设计了测定空气中氧气含量的实验,装置如图,该同学的实验步骤如下: