题目内容
【题目】推理和归纳是化学学习和研究中常用的思维方法。下列推理正确的是
A.氮气可做保护气,所以可做保护气的一定是氮气
B.物质燃烧时有热量放出,所以有热量放出的反应一定是燃烧反应
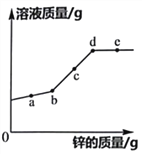
C.锌与稀硫酸反应后液体质量增加,所以镁、铁、铝与稀硫酸反应后液体质量也增加
D.Na+、Mg2+、Cl-的最外层电子数均为8,所以最外层电子数为8的粒子一定是离子
【答案】C
【解析】
A、氮气的化学性质不活泼,可做保护气,但是可做保护气的不一定是氮气,如稀有气体,不符合题意;
B、物质燃烧时有热量放出,但是有热量放出的反应不一定是燃烧反应,如氧化钙和水反应放热,但是不属于燃烧反应,不符合题意;
C、锌与稀硫酸反应![]() ,65份锌置换出2份的氢气,故反应后液体质量增加,镁与稀硫酸反应
,65份锌置换出2份的氢气,故反应后液体质量增加,镁与稀硫酸反应![]() ,24份镁置换出2份氢气,反应后液体质量增加,铁与稀硫酸反应
,24份镁置换出2份氢气,反应后液体质量增加,铁与稀硫酸反应![]() ,56份铁置换出2份氢气,反应后液体质量增加,铝与稀硫酸反应
,56份铁置换出2份氢气,反应后液体质量增加,铝与稀硫酸反应![]() ,54份铝置换出6份氢气,反应后液体质量增加,符合题意;
,54份铝置换出6份氢气,反应后液体质量增加,符合题意;
D、Na+、Mg2+、Cl-的最外层电子数均为8,但是最外层电子数为8的粒子不一定是离子,如氖原子的最外层电子数为8,不是离子,不符合题意。
故选C。

【题目】“五一”假期,小兵对“锌与硫酸反应快慢的影响因素”进行了探究.

(提出问题)锌与硫酸反应的快慢受哪些因素的影响呢?
(猜想与假设)a可能与硫酸的质量分数有关;b可能与锌的形状有关.
(设计并实验)小兵用不同质量分数的硫酸和不同形状的锌进行如下实验.
实验编号 | 硫酸的质量分数(均取20mL) | 锌的形状(均取1g) | 氢气的体积(mL)(均收集3分钟) |
① | 30% | 锌粒 | 31.7 |
② | 20% | 锌片 | 50.9 |
③ | 20% | 锌粒 | 61.7 |
④ | 30% | 锌片 | 79.9 |
(1)写出稀硫酸与锌反应的化学方程式______.
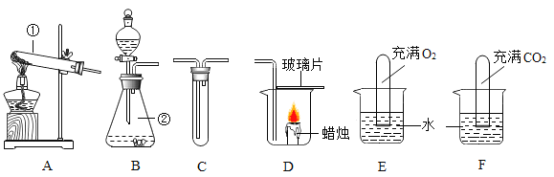
(2)小兵用如图装置收集并测量氢气的体积,其中量筒的作用是______,氢气应从______(填e或f或g)管通入.
(3)若用该收集CO2,并测量生成的CO2气体的体积,其中在水面上放一层植物油目的是______;
(收集证据)(4)要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是______.
(得出结论)(5)结论是______
(评价与反思)(6)下表是小兵第①组实验的详细数据.
时段(均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
H2的体积 | 3.1mL | 16.7mL | 11.9mL | 9.6mL | 7.6mL | 6.0mL |
请描述锌与硫酸反应的快慢的变化并解释原因______.
(7)锌与硫酸反应的快慢可能还受哪些因素影响?_____设计实验验证.______.
【题目】下表是几种原子或分子的示意图,根据图示的反应历程判断,下列说法错误的是( )
图例 |
|
|
|
|
|
|
|
|
原子或分子 | 1个A原子 | 1个B原子 | 1个C原子 | 1个D原子 | 1个AD2分子 | 1个B2分子 | 1个BD2分子 | 1个CB分子 |
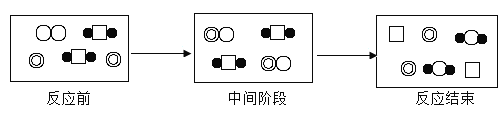
A.该反应是置换反应B.反应中间阶段发生了化合反应
C.反应结束阶段发生了复分解反应D.物质C是反应的催化剂