题目内容
小丽为除去食盐中混有的少量CaCl2、MgSO4杂质,设计了一种制备精盐的实验方案,步骤如下(用于生成沉淀反应的试剂稍加过量):

根据上述实验步骤,回答下列问题:
⑴步骤①、⑦中的操作分别为 、 ;
⑵步骤②中发生反应的化学方程式为 ;
⑶步骤④加入的试剂为 溶液;
⑷步骤⑤过滤后所得固体E的成分除Mg(OH)2外,还有(填化学式) 。
⑸步骤⑥中加入适量盐酸的作用是 。

根据上述实验步骤,回答下列问题:
⑴步骤①、⑦中的操作分别为 、 ;
⑵步骤②中发生反应的化学方程式为 ;
⑶步骤④加入的试剂为 溶液;
⑷步骤⑤过滤后所得固体E的成分除Mg(OH)2外,还有(填化学式) 。
⑸步骤⑥中加入适量盐酸的作用是 。
⑴ (加水)溶解 蒸发(结晶) ⑵MgSO4+BaCl2=BaSO4↓+MgCl2【说明:如步骤②加入Ba(OH)2溶液,也可,方程式则为MgSO4+Ba(OH)2=BaSO4↓+Mg(OH)2↓,给分】
⑶ Na2CO3 ⑷BaSO4、CaCO3和BaCO3
⑸除去过量的NaOH和Na2CO3(调节溶液的pH至中性)
完整的流程应该是:
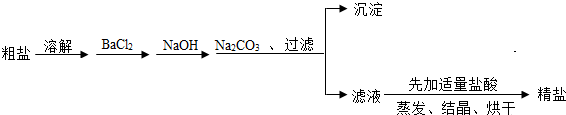
(1)用玻璃棒搅拌,加速了液体的流动,使固体很快溶解,故答案为:加速溶解.
(2)加入过量的氯化钡(或者氢氧化钡),氯离子对氯化钠来说不是杂质,钡离子可以将硫酸根离子转化为沉淀,故答案为:Na2SO4,;
(3)第④步溶液中剩下没有反应的氯化钡(或者氢氧化钡),第④步加入碳酸钠,除了将氯化钙沉淀以外,还可以除去过量的氯化钡(或者氢氧化钡),答案为:过量的Na2CO3.
(4)⑤中是前面所生成的BaSO4、CaCO3和BaCO3.故答案为:BaSO4、CaCO3和BaCO3.
(5)⑥步加盐酸目的是为了除去过量的NaOH和Na2CO3(调节溶液的pH至中性).
故答案为:
(1)(加水)溶解蒸发(结晶)(2)MgSO4+BaCl2=BaSO4↓+MgCl2【说明:如步骤②加入Ba(OH)2溶液,也可,方程式则为MgSO4+Ba(OH)2=BaSO4↓+Mg(OH)2↓,给分】
(3)Na2CO3(4)BaSO4、CaCO3和BaCO3
(5)除去过量的NaOH和Na2CO3(调节溶液的pH至中性)

(1)用玻璃棒搅拌,加速了液体的流动,使固体很快溶解,故答案为:加速溶解.
(2)加入过量的氯化钡(或者氢氧化钡),氯离子对氯化钠来说不是杂质,钡离子可以将硫酸根离子转化为沉淀,故答案为:Na2SO4,;
(3)第④步溶液中剩下没有反应的氯化钡(或者氢氧化钡),第④步加入碳酸钠,除了将氯化钙沉淀以外,还可以除去过量的氯化钡(或者氢氧化钡),答案为:过量的Na2CO3.
(4)⑤中是前面所生成的BaSO4、CaCO3和BaCO3.故答案为:BaSO4、CaCO3和BaCO3.
(5)⑥步加盐酸目的是为了除去过量的NaOH和Na2CO3(调节溶液的pH至中性).
故答案为:
(1)(加水)溶解蒸发(结晶)(2)MgSO4+BaCl2=BaSO4↓+MgCl2【说明:如步骤②加入Ba(OH)2溶液,也可,方程式则为MgSO4+Ba(OH)2=BaSO4↓+Mg(OH)2↓,给分】
(3)Na2CO3(4)BaSO4、CaCO3和BaCO3
(5)除去过量的NaOH和Na2CO3(调节溶液的pH至中性)

练习册系列答案
相关题目





 Ⅰ.利用纯碱和稀盐酸制取二氧化碳
Ⅰ.利用纯碱和稀盐酸制取二氧化碳


