题目内容
【题目】小伟同学利用碳酸钠溶液测定除锈剂(主要成分是硫酸)中硫酸的质量分数,实验过程如下:
①向烧杯中加入50 g除锈剂;(除锈剂中其他成分不与碳酸钠反应,反应中产生的气体全部逸出)
②向除锈剂中滴加碳酸钠溶液,边滴加边搅拌,至不再有气泡放出,共消耗碳酸钠溶液40 g;
③反应后,烧杯中剩余物质的总质量为87.8 g。
根据上述实验数据计算除锈剂中硫酸的质量分数__________。
【答案】9.8%
【解析】
根据质量守恒定律,反应后减小的质量是逸散到空气中的二氧化碳的质量,则二氧化碳的质量为:50 g+40 g-87.8 g=2.2g,设除锈剂中硫酸的质量为x。
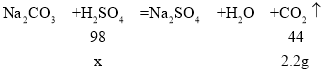
![]() ,解得x=4.9g
,解得x=4.9g
除锈剂中硫酸的质量分数为:![]() =9.8%
=9.8%
答:除锈剂中硫酸的质量分数为9.8%。

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目