��Ŀ����
����Ŀ�����л�ѧ���ϣ�ͬѧ��������������̽����Ļ�ѧ���ʣ�
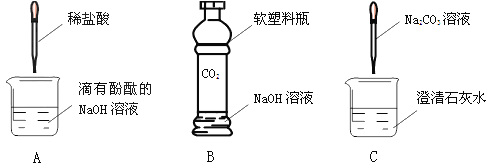
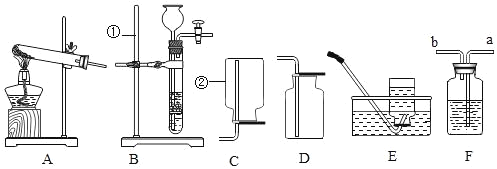
��1��Aʵ���з�����Ӧ�Ļ�ѧ����ʽΪ_______�������Ӧ����Ϊ_______��
��2��Bʵ���й۲쵽�����ԭ����________����������������
��3��Cʵ���пɹ۲쵽��������________��
��4��ʵ�������ͬѧ�ǽ���Һ����ͬһֻ��Һ���У�����ַ�Һ���Dz��Ժ�ɫ����֪��Һ��_____�ԡ�Ϊ̽����Һ�ijɷ֣�����Һ���ˣ�����Һ�м����������������Һ���õ���ɫ��������ɫ��ȥ������ͬѧ��ȷ����Һ�г���̪��̼��ơ�ˮ���⣬�϶�������________ ��һ��û��_________��
���𰸡�NaOH+HCl=NaCl+H2O ���ֽⷴӦ ƿ���� �а�ɫ�������� �� NaCl��Na2CO3 HCl�� NaOH��Ca(OH)2
��������
��1��Aʵ����ϡ������������Ʒ�Ӧ�����Ȼ��ƺ�ˮ����ѧ����ʽΪ��NaOH+HCl=NaCl+H2O���������ֻ����ﻥ�ཻ���ɷ������������ֻ�������ص㣬�������Ӧ����Ϊ�����ֽⷴӦ��
��2��Bʵ���ж�����̼���������Ʒ�Ӧ��ƿ��ѹǿ��С�����Թ۲쵽�����ԭ���ǣ�ƿ����
��3��Cʵ����̼������Һ�ͳ���ʯ��ˮ��Ӧ����̼��ƣ�̼���������ˮ�����Կɹ۲쵽�������ǣ��а�ɫ�������ɡ�
��4��ʵ�������ͬѧ�ǽ���Һ����ͬһֻ��Һ���У�����ַ�Һ���Dz��Ժ�ɫ����ΪAʵ����Һ���з�̪�����Է�Һ�Ժ�ɫ��˵����Һ�Լ��ԣ�Ϊ̽����Һ�ijɷ֣�����Һ���ˣ�����Һ�м����������������Һ���õ���ɫ��������ɫ��ȥ����Ϊ�����������������Һ���õ���ɫ������˵����Һ�к���̼���ƣ���Ϊ̼���ƺ�ϡ���ᡢ�������Ʋ��ܹ��棬������Һ��һ��û���������ƺ����ᣬ����Ϊ����Һ�м����������������Һ���õ���ɫ��������ɫ��ȥ��˵����Һ��һ��û���������ƣ��ټ���Aʵ�������ɵ��Ȼ��Ʋ��������漰���������ʷ�Ӧ�����ǿ���ȷ����Һ�г���̪��̼��ơ�ˮ���⣬�϶������У�NaCl��Na2CO3��һ��û�У�HCl�� NaOH��Ca(OH)2��

 ���ɶ��ȫ���ƿؾ�ϵ�д�
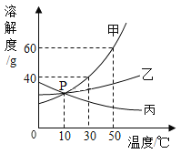
���ɶ��ȫ���ƿؾ�ϵ�д�����Ŀ������Դ�Ŀ������������������ɳ�����չ����Ҫ���⡣�⡢��ȼ�ϵ����һ��������Դ�����õ������ӿ����л�õķ�����______�������е�������������㣬��Լ�ǿ����������![]() ������������Ȼ����ȡ�����ַ�����ȡ���������������ж�����̼��һ����̼��Ϊ��֤�����������H2��CO2��CO�������嶼���ڣ�һ��ѧʵ��С���������ʵ�顣
������������Ȼ����ȡ�����ַ�����ȡ���������������ж�����̼��һ����̼��Ϊ��֤�����������H2��CO2��CO�������嶼���ڣ�һ��ѧʵ��С���������ʵ�顣
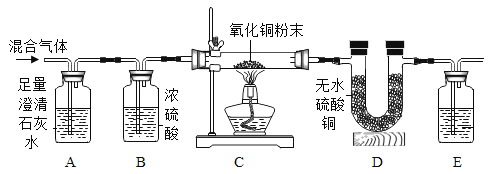
���Ķ���ʾ��
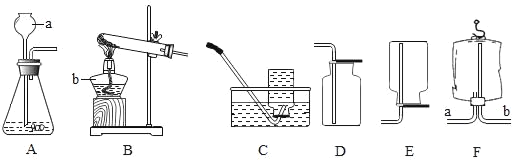
��ʵ��ǰ��װ���ڵĿ������ž���
��ʵ������е�β���Ѵ�����
����ˮ����ͭ�ǰ�ɫ��ĩ����ˮ�������
��ش��������⡣
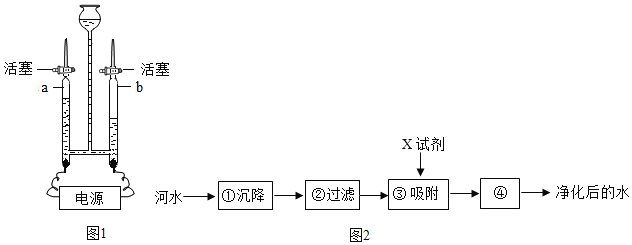
��1��Aװ�õ�������______��
��2��Cװ���е�ʵ��������______��
��3��Eװ����ʢ�ŵ��Լ�Ӧ����______����װ���з�����Ӧ�Ļ�ѧ����ʽΪ______��
��4��֤���������ڵ�ʵ��������______��
��5����һС��ͬѧ��������ʵ��װ�ã������е�Eװ�û���װ�м�ʯ�ҵĸ���ܣ�����������ʵ����̣�ͨ�������ķ���ȷ��һ����̼���ڣ���¼ʵ���������£�
��ע����Ӧ���ɵ�ˮ������Dװ����ȫ���գ�����������ˮ������ʵ������Ӱ�죩
ʵ��ǰCװ�ò������ڹ���������/g | m1 |
ʵ���Cװ�ò������ڹ���������/g | m2 |
ʵ��ǰDװ��������/g | n1 |
ʵ���Dװ��������/g | n2 |
����������ݣ��������֤��CO���ڵ�������ϵ��______������m1��m2��n1��n2��ʾ��