题目内容
化学上常用燃烧法测定有机物的组成.现取4.6g某有机物在足量氧气中充分燃烧,生成8.8g CO2和5.4g H2O,则该有机物中
- A.只含有碳、氢两种元素
- B.一定含有碳、氢、氧三种元素
- C.碳、氢元素的原子个数比为1:2
- D.碳、氢、氧元素的原子个数比为2:6:1
BD
分析:由题意“4.6g某有机物在足量氧气中充分燃烧,生成8.8gCO2和5.4gH2O”,则可知8.8gCO2和5.4gH2O中的碳元素和氢元素的质量,则可推测有机物是否含有氧元素.
解答:由题意“4.6g某有机物在足量氧气中充分燃烧,生成8.8gCO2和5.4gH2O”,则:
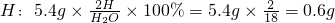
则O:4.6g-2.4g-0.6g=1.6g,设碳、氢、氧元素的原子个数分别为x、y、z,故C:H:O=2.4g:0.6g:1.6g=12x:y:16z,故x:y:z=2:6:1
A、只含有碳、氢两种元素,说法错误,故A错误;
B、经计算可知,一定含有碳、氢、氧三种元素,说法正确,故B正确;
C、碳、氢元素的原子个数比为1:2,说法错误,应为x:y=2:6=1:3,故C错误;
D、经计算可知,设碳、氢、氧元素的原子个数分别为x、y、z,故C:H:O=2.4g:0.6g:1.6g=12x:y:16z,故x:y:z=2:6:1,故D正确.
答案:B、D
点评:本题是运用化学中的基本思想质量守恒思想,通过归纳不同物质或不同变化过程中相同点和不同点有效地寻找出它们之间的内在联系以及融合点和嫁接点,从而培养了学生的创新思维能力.
分析:由题意“4.6g某有机物在足量氧气中充分燃烧,生成8.8gCO2和5.4gH2O”,则可知8.8gCO2和5.4gH2O中的碳元素和氢元素的质量,则可推测有机物是否含有氧元素.
解答:由题意“4.6g某有机物在足量氧气中充分燃烧,生成8.8gCO2和5.4gH2O”,则:

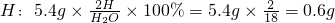
则O:4.6g-2.4g-0.6g=1.6g,设碳、氢、氧元素的原子个数分别为x、y、z,故C:H:O=2.4g:0.6g:1.6g=12x:y:16z,故x:y:z=2:6:1
A、只含有碳、氢两种元素,说法错误,故A错误;
B、经计算可知,一定含有碳、氢、氧三种元素,说法正确,故B正确;
C、碳、氢元素的原子个数比为1:2,说法错误,应为x:y=2:6=1:3,故C错误;
D、经计算可知,设碳、氢、氧元素的原子个数分别为x、y、z,故C:H:O=2.4g:0.6g:1.6g=12x:y:16z,故x:y:z=2:6:1,故D正确.
答案:B、D
点评:本题是运用化学中的基本思想质量守恒思想,通过归纳不同物质或不同变化过程中相同点和不同点有效地寻找出它们之间的内在联系以及融合点和嫁接点,从而培养了学生的创新思维能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
化学上常用燃烧法测定有机物的组成.现取4.6g某有机物在足量氧气中充分燃烧,生成8.8g CO2和5.4g H2O,则该有机物中( )
| A、只含有碳、氢两种元素 | B、一定含有碳、氢、氧三种元素 | C、碳、氢元素的原子个数比为1:2 | D、碳、氢、氧元素的原子个数比为2:6:1 |
化学上常用燃烧法测定有机物的组成。现取4.6g某有机物在足量氧气中充分燃烧,生成8.8g CO2和5.4g H2O,则该有机物中
| A.只含有碳、氢两种元素 | B.实验中用去氧气的质量为9.6g |
| C.碳、氢元素的原子个数比为1∶2 | D.该有机物可能为甲烷(CH4) |